Tres recientes investigaciónes han identificado genes relacionados con la progresión del cáncer de próstata que abren vías para la oncología de precisión.
El cáncer de próstata es una de las principales causas de mortalidad entre hombres a nivel mundial. Se estima que uno de cada ocho hombres desarrollará esta enfermedad en algún momento de su vida. Aunque su progresión suele ser lenta, el cáncer de próstata puede volverse agresivo y derivar en metástasis, lo que complica notablemente su tratamiento.
En los últimos años se han identificado diferentes genes relacionados con el desarrollo o progresión de este tipo de cáncer, así como con la resistencia al tratamiento. Sin embargo, todavía no se conocen todos los factores implicados.
Recientes investigaciones han contribuido a conocer mejor los factores genéticos que intervienen en el cáncer de próstata, al identificar genes implicados en su progresión o metástasis. Este tipo de estudios contribuyen a mejorar el diagnóstico y abren nuevas vías para el desarrollo de tratamientos dirigidos y medicina personalizada para los pacientes
Deficiencia de KMT2C y metástasis en cáncer de próstata
En el primero de los estudios, investigadores de la Universidad de Aarhus han identificado que la pérdida de actividad del gen KMT2C es necesaria para la metástasis del cáncer de próstata. Los resultados se publican en Nature Communications.
El objetivo de los investigadores era estudiar la base genética y epigenética de la progresión del cáncer de próstata. Para ello, el equipo utilizó nuevos modelos de la enfermedad en ratón. En primer lugar, el equipo indujo el cáncer de próstata mediante la inactivación de cinco genes supresores de tumores frecuentemente alterados en humanos: Trp53, Pten, Rb1, Stk11 y RnaseL. En este caso, observaron que los tumores progresaban pero no derivaban en metástasis. Posteriormente, los investigadores inactivaron también en el tejido de la próstata tres genes con función epigenética (Zbtb16, Kmt2c, and Kmt2d). En este escenario, encontraron que la progresión del cáncer era la misma, pero además se producía metástasis.
A través de estos y otros experimentos, los investigadores concluyeron que la pérdida del gen Kmt2c era la responsable de que se produjeran las metástasis. Además, el equipo identificó una región del genoma regulada por Kmt2c y detectó dos genes situados en esta región implicados en la formación de metástasis: Odam y Cabs.
Este estudio destaca la importancia de KMT2C en la progresión del cáncer, así como el potencial de la tecnología CRISPR, utilizada para editar el genoma e inactivar los genes de interés, para estudiar mecanismos complejos de la enfermedad. Además, subraya cómo la combinación de múltiples mutaciones en genes supresores de tumores y moduladores epigenéticos puede acelerar la progresión del cáncer y la formación de metástasis.
“Este gen es una prueba irrefutable en el desarrollo de la enfermedad, y podría constituir la base para examinar a los pacientes en el futuro”, ha señalado Martin K. Thomsen, investigador del Departamento de Medicina de la Universidad de Aarhus que ha dirigido el estudio. “Si el gen muta, existe el riesgo de que el paciente desarrolle metástasis. A largo plazo, podemos utilizar estos conocimientos para operar antes o vigilar más de cerca al grupo de pacientes.”
En proyectos futuros los investigadores planean identificar las rutas funcionales en las que intervienen los genes Odam y Cabs1 durante la metástasis. Adicionalmente investigarán en mayor profundidad otros genes candidatos localizados en la región de interés.
Deficiencia de ZNF397 y TET2 en el desarrollo de resistencia a tratamiento
En el segundo de los estudios, publicado en Cancer Discovery, investigadores del Centro Médico de la Universidad UT Southwestern han identificado dos genes que actúan juntos para definir el comportamiento de las células del cáncer de próstata.
En este caso los investigadores buscaban identificar factores genéticos que intervinieran en la plasticidad celular que permite a algunos linajes de células de cáncer de próstata evadir los tratamientos frente a ellas.
El equipo identificó que los genes ZNF397 y TET2 son fundamentales para esta plasticidad y la resistencia a terapia en cáncer de próstata. A partir de diversos experimentos se encontró que el déficit de actividad de ZNF397 induce la transición de las células tumorales desde un estado de dependencia de la señalización mediada por el receptor de andrógenos a una mayor dependencia de la proteína TET2. A través de su función reguladora de la metilación, TET2 contribuye a reprogramar las células haciéndolas más flexibles y adaptables. Y este estado favorece que adquieran resistencia a las terapias dirigidas al receptor de andrógenos.
Los resultados del trabajo apuntan a TET2 como potencial diana terapéutica para contrarrestar la resistencia a la terapia dirigida al receptor de andrógenos en tumores con deficit de ZNF397. De hecho, los estudios preliminares en líneas celulares realizados por los investigadores indican que la inhibición de TET2 reduce la plasticidad de las células tumorales defectuosas para ZNF397. Su aplicabilidad en pacientes deberá evaluarse en ensayos clínicos.
“La posibilidad de revertir este tipo de resistencia dirigiéndose a TET2 con fármacos ofrece nuevas vías para desarrollar tratamientos para pacientes con cáncer de próstata avanzado”, ha destacado Ping Mu, profesor de Biología Molecular en el centro médico de la Universidad UT Southwestern. “Estos conocimientos podrían conducir a ensayos clínicos que probaran inhibidores de TET2 en el tratamiento de pacientes con cáncer de próstata metastásico resistente a la castración, mejorando potencialmente los resultados del tratamiento y aumentando las tasas de supervivencia”.
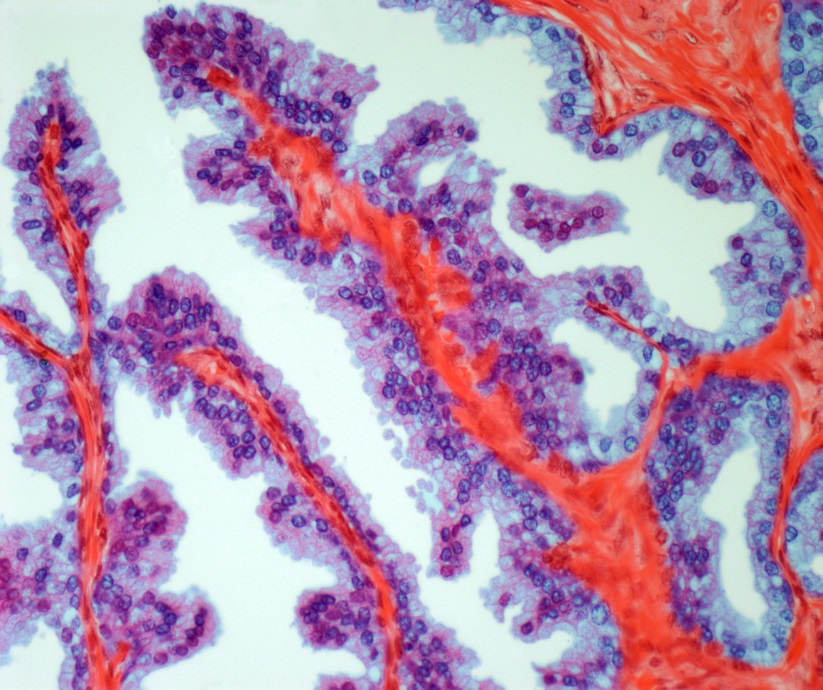
Tejido de cáncer de próstata. Imagen: Canva.
La actividad elevada de JUN retrasa el crecimiento del cáncer de próstata
El tercero de los estudios, realizado por investigadores de la Universidad Médica de Viena y publicado en la revista Molecular Cancer, revela que altos niveles del gen JUN ralentizan el crecimiento del cáncer de próstata.
En este caso, los investigadores buscaban determinar la contribución de JUN en la progresión del cáncer de próstata. En otros tipos de cáncer una elevada actividad de JUN está relacionada con una progresión del cáncer. Sin embargo, a partir de muestras de pacientes y de modelos de ratón, el equipo observó que en cáncer de próstata se produce el efecto contrario.
Los resultados del trabajo plantean que en el cáncer de próstata JUN actúa como gen supresores de tumores y frena la progresión tumoral a través de la regulación de genes relacionados con la inflamación o la senescencia. “Descubrimos que JUN interviene significativamente en la regulación del cáncer de próstata al influir en la respuesta inmunitaria del organismo”, ha señalado Sabine Lagger, investigadora de la Universidad de Medicina Veterinaria de Viena.
Nuevos avances hacia terapias personalizadas
La identificación de los genes KMT2C, ZNF397, TET2 y JUN como factores críticos en la evolución del cáncer de próstata amplía el conocimiento sobre los mecanismos moleculares y genéticos que impulsan la progresión y metástasis del cáncer de próstata. Además, también proporciona nuevas dianas para el desarrollo de terapias de precisión adaptadas a las características moleculares de los tumores. Estudios clínicos futuros deberán evaluar su efectividad real para los pacientes.
Genética en cáncer de próstata
- mayo 4, 2022
Rubén Megía González
¡Hola! Hace relativamente poco te hablábamos de la importancia de la Genética y la Genómica en Oncología. Hoy, me gustaría ir más allá y centrarme únicamente en la relevancia de estas disciplinas en el diagnóstico del cáncer de próstata, el tipo de cáncer más frecuente en varones. ¿Quieres saber más sobre este tema? ¡Sigue leyendo, porque te explicamos todo al dedillo!
El cáncer de próstata: ¿Qué es y con qué frecuencia se presenta?
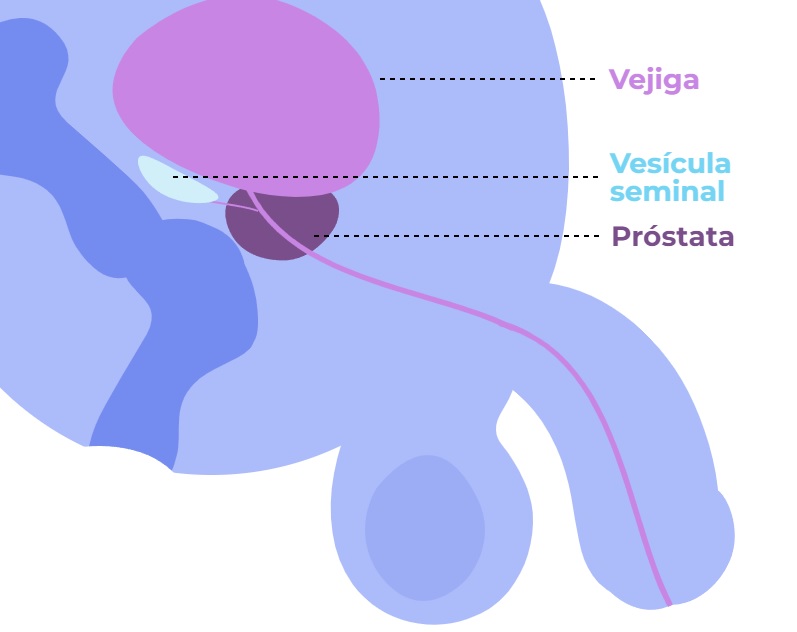
La próstata es una glándula que se encuentra bajo la vejiga únicamente en individuos varones. Su función principal es secretar el líquido prostático, sustancia que forma parte del semen y que favorece la movilidad de los espermatozoides, aumentando la probabilidad de fecundar un óvulo. Otra de las funciones de la próstata es actuar como “válvula” para evitar la salida de la orina durante el coito.
El cáncer de próstata es una enfermedad de origen genético que afecta al ciclo celular de ciertos grupos celulares de la próstata. Se trata del tipo de cáncer más frecuente en hombres y se diagnostica a alrededor de un millón y medio de personas cada año en todo el mundo.
Marcadores genéticos en cáncer de próstata
Al igual que en muchos otros tipos de cáncer, diferentes estudios genómicos han ayudado a determinar variantes genéticas de riesgo que aumentan la probabilidad de desarrollar cáncer de próstata. Esto no significa que una persona con alguna de estas variantes vaya a desarrollar este tipo de cáncer con un 100% de probabilidad, aunque sí aumenta el riesgo frente a otras personas que no tienen dichas variantes.
La mayoría de las variantes genéticas de riesgo asociadas al desarrollo del cáncer de próstata se encuentran en genes relacionados con las vías de reparación del ADN. El ejemplo más común son los genes BRCA1 y BRCA2, genes supresores de tumores que se encargan de reparar los daños en el ADN que se puedan producir de forma natural o como resultado de una exposición a ciertos elementos nocivos. Otros genes supresores de tumores relacionados con el desarrollo de este tipo de cáncer son ATM, CHEK2, RAD51D y PALB2.
Otro de los genes que se han relacionado con la proliferación del cáncer de próstata es el gen HOXB13, que codifica un factor de transcripción capaz de regular la expresión de otras regiones del genoma. Por el momento, se han encontrado al menos dos variantes genéticas de este gen relacionadas con el desarrollo de cáncer de próstata.
Herencia en cáncer de próstata
Al igual que otras enfermedades de causa genética, el cáncer de próstata puede ser hereditario. En concreto, se estima que alrededor del 5% de los casos de este tipo de cáncer tienen un origen hereditario. Por este motivo, la Sociedad Española de Oncología Médica recomienda el estudio genético en pacientes con historial familiar de cáncer de próstata, páncreas, mama u ovario o en hombres sanos pertenecientes a familias con variantes que predisponen a desarrollar algún tipo de cáncer.
Una prueba genética en orina para detectar el cáncer de próstata
Investigadores de la Universidad de Michigan ha desarrollado y validado una prueba, basada en la expresión de varios genes en orina que identifica con una sensibilidad elevada los cánceres de próstata más avanzados.
El cáncer de próstata es el segundo cáncer más frecuente y la tercera causa de muerte por cáncer en hombres. En las últimas décadas, el diagnóstico temprano y los avances en los tratamientos han favorecido que la tasa de mortalidad en hombres con cáncer de próstata disminuya. Los cribados basados en el antígeno prostático (PSA) han contribuido notablemente al diagnóstico temprano de la enfermedad. Sin embargo, también pueden derivar en falsos positivos que llevan a la realización de biopsias innecesarias o a un sobrediagnóstico de cánceres de bajo grado.
Para solucionar este problema las guías recomiendan realizar una prueba de imagen cuando los niveles de PSA son elevados. No obstante, esta estrategia tampoco es óptima, ya que un resultado negativo no permite descartar completamente la presencia de cáncer. Así, para mejorar la detección del cáncer, es esencial la identificación de nuevos biomarcadores más específicos y sensibles. De especial interés son los marcadores genéticos, que informan de la composición del cáncer o los marcadores de expresión génica, que informan sobre qué genes están activos en un tejido concreto.
En este escenario, un equipo de investigadores de la Universidad de Michigan ha desarrollado y validado una prueba, basada en la expresión de varios genes en orina que identitifica con una sensibilidad elevada los cánceres de grado alto (aquellos con células tumorales con mayor capacidad de propagación). Los resultados se han publicado en JAMA Oncology
Desarrollando una prueba para detectar cáncer de próstata en orina
Para identificar marcadores genéticos de cáncer de próstata en orina, los investigadores analizaron la expresión génica en tejido de próstata normal y tejido con cáncer de diverso grado. A partir de varios filtros, el equipo definió 54 posibles genes candidatos para desarrollar un panel diagnóstico en orina. A continuación, evaluaron la efectividad de diferentes combinaciones de estos genes en una muestra de 761 hombres, de los cuales 151 tenía un resultado de cáncer de próstata de alto grado obtenido en una biopsia.
Los resultados indicaron que expresión combinada de 18 genes, sumada a información clínica, tenía una sensibilidad del 95% para detectar cánceres de próstata de grado 2 y una sensibilidad del 99% para detectar el cáncer de próstata de grado 3. Los genes son: SCHLAP1, APOC1, B3GNT6, NKAIN1, PCGEM1, SPON2, TRGV9, PCA3, OR51E2, CAMKK2, TFF3, PCAT14, TMSB15A, HOXC6, ERG, TMPRSS2:ERG, KLK4 y KLK3, que codifica PSA, como referencia.
La prueba también reveló un 99% de valor predictivo negativo para el cáncer de grado 3 o más. Este dato es importante porque refleja la proporción de hombres realmente diagnosticados como negativos con respecto a todos los que obtuvieron resultados negativos en las pruebas. Esta característica, importante para la utilización de una prueba en un entorno clínico, puede predecir la probabilidad de que alguien esté realmente sano, en caso de que el resultado de la prueba sea negativo.
35% de biopsias podrían evitarse con la prueba de expresión génica
Un desafío en el diagnóstico del cáncer de próstata es resolver la tasa de falsos positivos para la prueba basada en PSA, que puede derivar en biopsias innecesarias para los pacientes.
El test de 18 genes desarrollado por los investigadores de la Universidad de Michigan, denominado MPS2, que analiza la expresión génica en orina, ha demostrado una buena precisión diagnóstica para el cáncer de próstata de alto grado en comparación con las pruebas de biomarcadores existentes.
Ante estos resultados los investigadores argumentan que su uso clínico podría disminuir significativamente las biopsias innecesarias en pacientes con niveles elevados de PSA. “Desde el punto de vista clínico, el uso de esta prueba habría evitado de forma segura pruebas adicionales innecesarias con diagnóstico por imagen o biopsia en el 35% al 51% de los pacientes, manteniendo al mismo tiempo una alta sensibilidad para los cánceres de alto grado que pueden beneficiarse de la detección precoz”, concluyen los autores del trabajo. “Estos hallazgos sugieren que el uso de la prueba en pacientes con niveles elevados de PSA puede reducir los daños potenciales del cribado del cáncer de próstata y preservar sus beneficios a largo plazo”.
De momento, sin embargo, serán necesarios más estudios para evaluar en detalle la efectividad y aplicabilidad clínica de la prueba MPS2.
Artículo científico: Tosoian JJ, et al. Development and Validation of an 18-Gene Urine Test for High-Grade Prostate Cancer. JAMA Oncol. 2024 Apr 18. doi: http://dx.doi.org/10.1001/jamaoncol.2024.0455
Fuentes: Development and Validation of an 18-Gene Urine Test for High-Grade Prostate Cancer. https://www.pathology.med.umich.edu/news/1534/
Artículos científicos
Cai, H., Zhang, B., Ahrenfeldt, J. et al. CRISPR/Cas9 model of prostate cancer identifies Kmt2c deficiency as a metastatic driver by Odam/Cabs1 gene cluster expression. Nat Commun 15, 2088. 2024. https://doi.org/10.1038/s41467-024-46370-0
Xu Y, et al. ZNF397 Deficiency Triggers TET2-driven Lineage Plasticity and AR-Targeted Therapy Resistance in Prostate Cancer. Cancer Discov. 2024 Apr 8. doi: http://dx.doi.org/10.1158/2159-8290.CD-23-0539
Redmer T, et al. JUN mediates the senescence associated secretory phenotype and immune cell recruitment to prevent prostate cancer progression. Mol Cancer. 2024 May 29;23(1):114. doi: http://dx.doi.org/10.1186/s12943-024-02022-x
Tratamiento más eficaz y menos agresivo del cáncer de próstata