Moviendo la aguja en el seguimiento del cáncer de piel
21 de agosto de 2023
Las microagujas y las mediciones ultrasensibles de una sola molécula permiten monitorear los biomarcadores de proteínas en las respuestas a una inmunoterapia combinada contra el melanoma
Por Benjamin Boettner
(BOSTON) — Los pacientes con melanoma, la forma más preocupante de cáncer de piel en la que las células productoras de pigmento comienzan a crecer sin control, pueden beneficiarse de las inmunoterapias existentes, pero no todas lo hacen. Más del 50 % de los pacientes no responden a los medicamentos de inmunoterapia actuales y, entre los que responden inicialmente, muchos se vuelven resistentes a los efectos de los medicamentos. Por lo tanto, además de desarrollar inmunoterapias más efectivas, los médicos deben poder determinar qué pacientes responden bien al inicio de los tratamientos y cuáles mantienen o dejan de responder para tomar las mejores decisiones de tratamiento.
Debido a que las lesiones cancerosas de la piel de los pacientes con melanoma son fácilmente accesibles, una forma efectiva de erradicarlas podría ser aplicar inmunoterapias localmente, en lugar de infundirlas sistémicamente en la circulación sanguínea. Además, monitorear la reacción del sistema inmunitario a la terapia justo en el sitio del tumor, midiendo de manera sensible y continua diferentes biomarcadores que señalan la activación prevista de las células inmunitarias y una respuesta inflamatoria deseable, podría permitir una atención al paciente mejor y más personalizada.
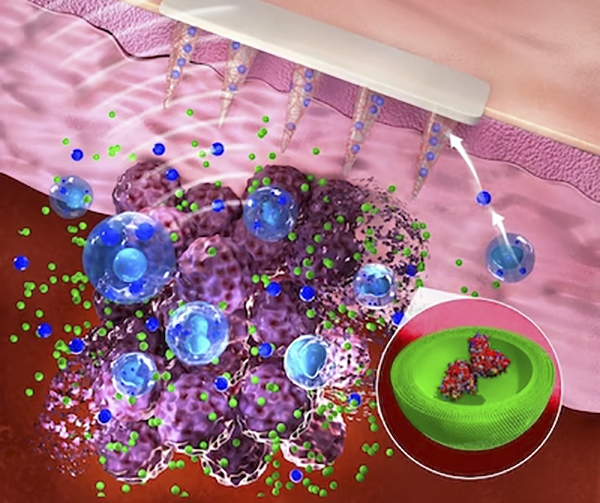
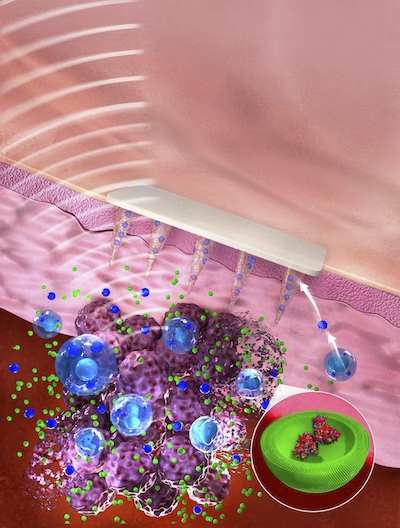
Un nuevo estudio demuestra cómo se pueden tomar muestras de moléculas biomarcadoras de lesiones de melanoma utilizando microagujas y medirlas con ensayos ultrasensibles de Simoa de una sola molécula. Este enfoque se utilizó para evaluar las respuestas inmunológicas en lesiones tumorales de ratones a una nueva inmunoterapia innovadora y también aplicada localmente. En el futuro, esta estrategia de monitoreo de biomarcadores podría ayudar a estratificar a los pacientes y maximizar los beneficios terapéuticos de las inmunoterapias. Crédito: Servicios de edición de Wiley
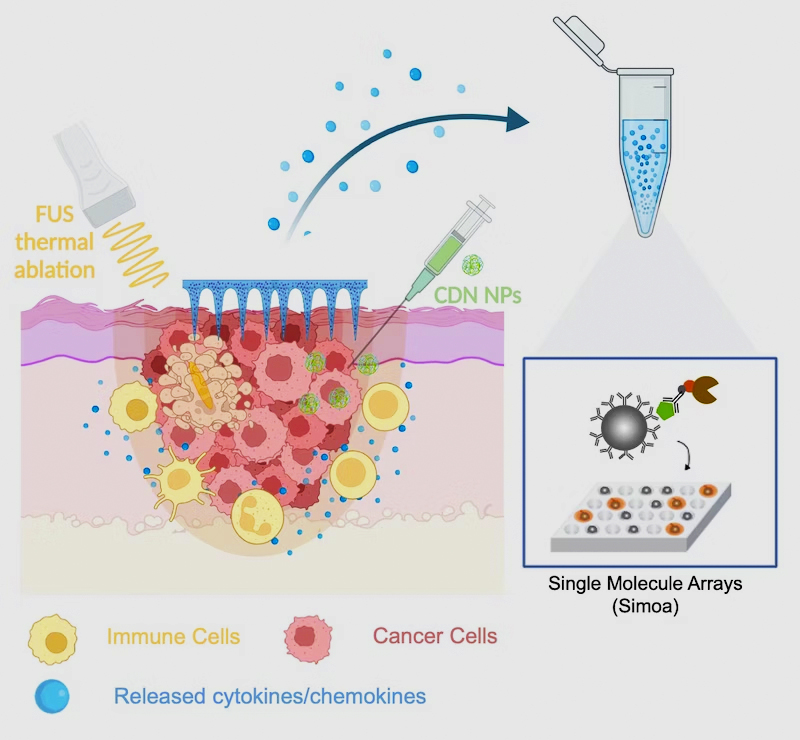
Ahora, un equipo de investigación del Instituto Wyss de la Universidad de Harvard, el MIT y el Hospital Brigham and Women’s de Boston ha desarrollado un nuevo enfoque que integra una plataforma de microagujas mínimamente invasiva e indolora capaz de absorber el líquido que rodea las células y que contiene biomarcadores desde zonas más profundas. capas de la piel con un método ultrasensible de detección de una sola molécula (Simoa) que detecta biomarcadores a menudo raros pero relevantes con mayor sensibilidad que los métodos convencionales. Los investigadores proporcionaron una prueba de concepto para su enfoque en un modelo de melanoma de ratón en el que trataron lesiones cancerosas con una terapia novedosa. La terapia actúa localmente sobre las lesiones tumorales ya que combina ultrasonido enfocado no invasivo (FUS), que genera calor en el sitio del tumor para matar instantáneamente las células tumorales, con la entrega de un activador unido a nanopartículas desarrollado previamente de una proteína inductora de inflamación conocida como estimulador de genes de interferón (STING). Los hallazgos se informan enMateriales Funcionales Avanzados .
“La lectura rápida de las respuestas a la terapia del melanoma con microagujas puede permitir la detección eficaz de fármacos y la estratificación de los pacientes para maximizar los beneficios terapéuticos”, dijo Natalie Artzi , Ph.D., miembro de la facultad asociada de Wyss, quien dirigió el estudio. Artzi también es profesor asociado de medicina en la Escuela de Medicina de Harvard (HMS) y científico investigador principal en el Instituto de Ingeniería y Ciencias Médicas del MIT.
La lectura rápida de las respuestas a la terapia del melanoma con microagujas puede permitir una detección eficaz de fármacos y la estratificación de los pacientes para maximizar los beneficios terapéuticos. NATALIE ARTZI
Inmunoterapia hecha local
Artzi y su grupo primero desarrollaron una inmunoterapia aplicada localmente para el melanoma que aprovechó algunos de sus métodos y experiencia previamente pioneros. En una publicación reciente , que se basó en el hecho conocido de que la activación de la proteína STING que induce la inflamación contribuye a la eliminación de células tumorales, informaron una forma significativamente más efectiva de activar la proteína en las células inmunitarias. Los activadores naturales (agonistas) de STING no son lo suficientemente estables en el cuerpo y deben administrarse en dosis altas que también pueden producir efectos secundarios. La solución del grupo fue entregar múltiples copias de un agonista STING sintético, llamado dinucleótido cíclico sintético (CDN), a través denanopartículas (NP) que atraviesan fácilmente la membrana plasmática y, con la ayuda de una reacción enzimática diseñada, liberan su carga dentro de las células. Este agente terapéutico CDN-NP se puede inyectar directamente en o cerca de lesiones cutáneas cancerosas para aumentar adicionalmente la concentración del fármaco en los tumores.
“Aquí, elegimos impulsar el procesamiento de antígenos de las células tumorales moribundas después de un ultrasonido enfocado junto con la administración de agonistas STING en el microambiente tumoral para coordinar una respuesta inmune más amplia”, dijo el primer autor Daniel Dahis , Ph.D. Dahis, es un científico investigador en la puesta en marcha de BioDevek, y realizó su trabajo de posgrado en el estudio con Artzi mientras era co-supervisado por el coautor Haim Azhari, Ph.D. , profesor en el Instituto Tecnológico Technion de Israel y experto en imagenes medicas.
El equipo demostró por primera vez que el tratamiento con ultrasonido focalizado (FUS), que aumenta la temperatura de forma transitoria y en áreas pequeñas hasta 60 °C, potenció los efectos del tratamiento con CDN-NP en cocultivos de células inmunitarias y cancerosas en una placa, y en tumores de melanoma en ratones, que trataron con la combinación. Es importante destacar que, 60 días después del tratamiento, todos los animales que recibieron solo la terapia con FUS habían muerto, mientras que el 75 % de los animales que recibieron solo la terapia con CDN-NP seguían vivos; el tratamiento combinado permitió que el 100 % de los animales de su grupo sobrevivieran.
Aprovechando profundamente los biomarcadores de la piel
Para investigar si los beneficios de supervivencia de la terapia combinada se reflejan en los niveles de biomarcadores en el sitio del tumor, lo que en el futuro podría traducirse en el seguimiento de las respuestas en pacientes humanos tratados con inmunoterapia, el grupo de Artzi había desarrollado previamente un nuevo tipo de biomarcadores mínimamente microaguja invasivas que están hechos de ácido hialurónico y, en principio, pueden usarse para administrar medicamentos y detectar biomarcadores simultáneamente. Estos dispositivos alcanzan las capas inferiores (dérmicas) de la piel donde el polímero se encuentra con el líquido que rodea las células de la piel, el llamado líquido intersticial de la piel (ISF) y, como una esponja, absorbe pequeñas cantidades de él. “Solo unos pocos microlitros de ISF obtenidos con microagujas brindan una gran cantidad de información de biomarcadores, ya que las células normales de la piel, las células inmunitarias locales y las células cancerosas secretan constantemente diversas moléculas de señalización y metabolitos”, dijo Dahis. “Después de recuperar las microagujas, sus puntas se pueden disolver simplemente para liberar las moléculas capturadas en un tubo de ensayo para que podamos comenzar el análisis de biomarcadores”.
Sin embargo mientras que los investigadores vieron claramente que FUS se sumaba a la respuesta inmunitaria evocada por CDN-NP en tumores, muchos biomarcadores de interés, incluidos los genes activados por la proteína STING activada, eran apenas detectables o no detectables en absoluto utilizando métodos convencionales. Para superar este cuello de botella, el equipo de Artzi unió fuerzas con las del miembro de la facultad de Wyss Core, David Walt., Ph.D., que había desarrollado previamente la tecnología Simoa, que tiene capacidades de detección de biomarcadores ultrasensibles. Simoa esencialmente permite a los investigadores capturar una proteína biomarcadora de interés con una molécula de anticuerpo específica que está unida a una perla magnética mucho más grande que el propio anticuerpo. Luego, la proteína unida se “empareda” con la ayuda de un segundo anticuerpo detector en pocillos individuales de una placa de pocillos múltiples en la que cada uno solo puede caber una perla magnética. El anticuerpo detector está marcado con una enzima que genera una señal fluorescente en el pocillo. Por lo tanto, Simoa permite el recuento digital de proteínas biomarcadoras individuales a nivel de una sola molécula, lo que supera con creces la sensibilidad de los ensayos de detección de uso común.
Coautor Tal Gilboa , Ph.D. El equipo de Walt desarrolló cuatro ensayos Simoa para detectar moléculas cuya expresión es activada por STING: interferón-b (IFN-b), MCP-1 y KC, que atraen células inmunitarias a los tumores, así como el marcador de inflamación general interleucina-6 (IL-6). De hecho, esto permitió a los investigadores detectar estos biomarcadores en muestras de ISF extraídas con microagujas con sensibilidades entre 100 y 1000 veces mayores en comparación con los ensayos de uso común, y las mediciones reflejaron las mediciones paralelas de Simoa de los mismos biomarcadores en muestras de sangre. “Fue sorprendente ver que los animales con la respuesta proinflamatoria más pronunciada también fueron los que sobrevivieron más tiempo”, dijo Dahis.
La extraordinaria tecnología de microagujas del laboratorio Artzi que contiene nanoestructuras diseñadas, en principio, permite tanto la administración de fármacos como el micromuestreo: un concepto completamente nuevo para un teranóstico, que proporciona una solución ideal, no invasiva y completa para el tratamiento del melanoma. DAVID WALT
quien también es Profesor Hansjörg Wyss de Ingeniería Biológicamente Inspirada en la Facultad de Medicina de Harvard (HMS), Profesor de Patología en el Brigham and Women’s Hospital y Profesor del Instituto Médico Howard Hughes (HHMI). Walt, junto con el coautor Rushdy Ahmad, Ph.D., lidera el Acelerador de diagnóstico Wyss, cuyo objetivo es acortar el marco de tiempo para los diagnósticos que se necesitan con urgencia en múltiples áreas de enfermedades, incluido el cáncer.
“Este trabajo es un hermoso ejemplo de colaboración interdisciplinaria y convergencia de tecnologías de vanguardia por las que nos esforzamos en el Instituto Wyss.
Este nuevo avance tiene el potencial de elevar la calidad de la inmunoterapia contra el cáncer al siguiente nivel mediante la evaluación directa de la eficacia terapéutica en pacientes individuales”, dijo el director fundador de Wyss, Donald Ingber , MD, Ph.D., quien también es profesor Judah Folkman de Vascular Biología en la Escuela de Medicina de Harvard y el Hospital de Niños de Boston, y la cátedra Hansjörg Wyss de Ingeniería Bioinspirada en la Escuela de Ingeniería y Ciencias Aplicadas John A. Paulson de Harvard.
Otros autores del estudio son Michelle Dion, Alexander Cryer, Pere Dosta, Mariana Alonso, Michael Lewandowski, Núria Puigmal, Gonzalo Muños Taboada y Haim Azhari. El estudio fue apoyado por el Technion Institute of Technology, el MIT-Israel Zuckerman STEM Fund (con el premio n.° 2214110), el Technion Integrated Cancer Center, el Diagnostic Accelerator (DxA) del Wyss Institute y un Binational Science Fund–Prof. Beca Rahamimoff Travel, así como un Premio al Desarrollo de la Mujer del Instituto Weizmann de Ciencias.
WYSS, Identificar «patitos feos» para contraer cáncer de piel antes
Aplicación móvil ayuda a detectar cáncer de piel en pacientes mayores