WYSS , Fibrosis quística
Fielmente modelada en un chip de vías respiratorias de pulmón humano
19 de noviembre de 2021
El primer modelo preclínico de microfluidos de órgano en un chip de las vías respiratorias pulmonares de la fibrosis quística podría ayudar a traer medicamentos nuevos y muy necesarios, y enfoques de medicina personalizada para los pacientes
Por Benjamin Boettner
(BOSTON) – El trastorno progresivo hereditario de la fibrosis quística (FQ) causa un daño severo a los pulmones y otros tejidos del cuerpo al afectar las células que producen moco, sudor y jugos digestivos. En individuos portadores de mutaciones en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR), que codifica un canal iónico que controla el flujo de iones y agua dentro y fuera de las células, el moco en las vías respiratorias y otros conductos, que normalmente es delgado y resbaladizo, se vuelve pegajoso y espeso; por lo tanto, en lugar de actuar como lubricante, se convierte en un coagulante. WYSS , Fibrosis quística WYSS , Fibrosis quística WYSS , Fibrosis quística
Los avances en las pruebas de detección de pacientes y las terapias innovadoras permiten que los pacientes con FQ vivan ahora hasta mediados o finales de los 30 o 40 años, a veces incluso más. Sin embargo, incluso el ~ 90% de los pacientes (que dependen del continente) con la mutación CFTR más común, denominada ΔF508, que pueden tratarse con los medicamentos disponibles, todavía están plagados de bacterias que se asientan en su moco, lo que causa inflamación en los pulmones. Los episodios repetidos de infección e inflamación, así como una inflamación crónica de menor grado entre infecciones, debilitan y cicatrizan gradualmente las vías respiratorias de los pacientes, lo que finalmente hace que sus sistemas respiratorios fallen. Para el ~ 10% restante de los pacientes con otras mutaciones de CFTR, aún no existen tratamientos dirigidos. Una barrera importante para el desarrollo de tratamientos nuevos y que se necesitan con urgencia es la falta de recursos humanos in vitro. modelos que recapitulan la patología de la enfermedad de la FQ.
Ahora, un equipo de investigación multidisciplinario en el Instituto Wyss de Ingeniería de Inspiración Biológica de Harvard dirigido por el Director Fundador de Wyss, Donald Ingber , MD, Ph.D. y con el apoyo de una subvención de la Cystic Fibrosis Foundation , han desarrollado un dispositivo de chip de órgano de microfluidos del tamaño de una memoria USB que recapitula las principales características patológicas de los pacientes con FQ con mayor precisión que otros in vitro.los sistemas tienen hasta ahora. El modelo replica los cambios específicos de la FQ en múltiples características distintivas de la enfermedad, incluida la capa de moco de las vías respiratorias, el latido de los cilios transportadores de moco, el crecimiento de patógenos, las moléculas inflamatorias y el reclutamiento de glóbulos blancos, proporcionando un modelo humano preclínico completo en el que para investigar nuevas terapias para la FQ. Los hallazgos se publican en la revista Journal of Cystic Fibrosis .
Las capacidades combinadas de este modelo in vitro avanzado pueden ayudar a acelerar la búsqueda de medicamentos que puedan amortiguar la respuesta inmune exagerada en los pacientes, tratarlos con terapias más personalizadas y ayudar a resolver los problemas que los pacientes con FQ enfrentan todos los días y que no pueden abordarse con los tratamientos existentes. .
“Ahora que somos capaces de modelar con precisión la patología de la FQ, incluidas las respuestas microbioma e inflamatoria, en chips de vías respiratorias humanas, tenemos una forma de atacar los desafíos que son importantes para los pacientes con FQ”, dijo Ingber. “Las capacidades combinadas de este modelo in vitro avanzado pueden ayudar a acelerar la búsqueda de fármacos que puedan amortiguar la respuesta inmune exagerada en los pacientes, tratarlos con terapias más personalizadas y ayudar a resolver los problemas que los pacientes con FQ enfrentan todos los días y que no pueden ser abordados por los tratos.” Ingber también es líder de la facultad de la Plataforma de Diagnóstico y Terapéutica Bioinspired de Wyss, así como el Profesor de Biología Vascular Judah Folkman. en la Escuela de Medicina de Harvard y el Hospital de Niños de Boston, y profesor de Bioingeniería en la Escuela de Ingeniería y Ciencias Aplicadas John A. Paulson de Harvard.
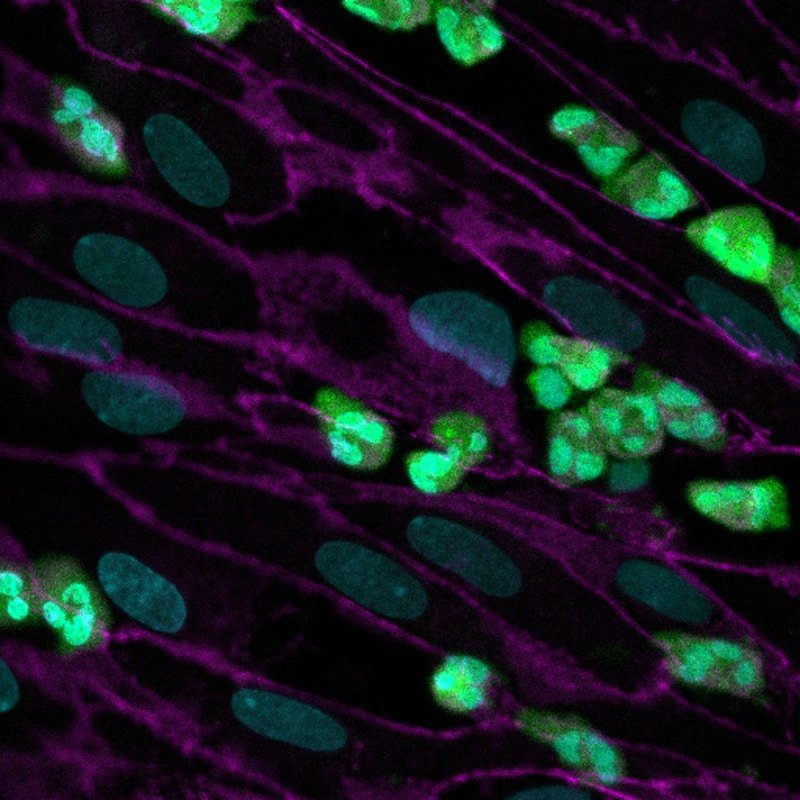
Esta imagen muestra cómo los neutrófilos (fluorescentes en verde) que se agregaron al canal sanguíneo se han adherido al endotelio (con las células delineadas con un marcador en magenta) y transmigran al epitelio en el canal paralelo. Crédito: Instituto Wyss de la Universidad de Harvard
“Este primer modelo microfisiológico de una vía aérea con FQ imita de cerca lo que sabemos de las vías respiratorias en pacientes con FQ. Manteniendo la composición típica de todos los tipos de células relevantes, desarrolló una capa de moco más espesa y sus células ciliadas exhiben densidades más altas de cilios que laten con una frecuencia más alta en comparación con los chips de las vías respiratorias creados con las células de las vías respiratorias de individuos sanos ”, dijo el co-primer autor. y ex becario postdoctoral en el equipo de Ingber Ratnakar Potla, MBBS, Ph.D. “Es importante destacar que estos cambios patológicos se acompañaron de una respuesta inflamatoria mejorada en el epitelio bronquial de la FQ modelada que es muy similar a la que se observa en los pacientes con FQ”. Potla es ahora científico senior de sistemas complejos in vitro en Genentech-Roche.Para modelar y comparar la microestructura y la función de las vías respiratorias de la FQ vascularizada, los autores cultivaron células de las vías respiratorias pulmonares obtenidas de pacientes humanos con FQ o de individuos sanos en uno de los dos canales huecos paralelos de un dispositivo de microfluidos bajo el aire, recapitulando el entorno de transporte de aire del pulmón. En el segundo canal, que está separado del primero por una membrana porosa, recrearon un vaso sanguíneo humano a partir de células microvasculares de pulmón humano que fue perfundido con un medio sustituto de sangre.
Después de cultivar los chips de las vías respiratorias durante dos semanas, los investigadores midieron los niveles de factores proinflamatorios y antiinflamatorios que fluían del canal vascular del chip de las vías respiratorias y que se sabe que están involucrados en la respuesta inflamatoria en los pulmones de los pacientes con FQ. Entre otros cambios, el nivel de la citocina proinflamatoria IL-8 aumentó en los chips de FQ en comparación con los de los chips de las vías respiratorias de control. Curiosamente, la IL-8 es conocida por su capacidad para atraer el tipo de glóbulos blancos conocidos como neutrófilos que también provocan inflamación en los pulmones de los pacientes con FQ.
Cuando los investigadores hicieron fluir los neutrófilos humanos a través del canal vascular de los chips de las vías respiratorias de la FQ, observaron que más células inmunes se adhirieron espontáneamente a la superficie de las células vasculares, se comprimieron a través de la capa de células vasculares y la membrana porosa, y se acumularon en la superficie de las células vasculares. capa de células epiteliales de las vías respiratorias del canal de aire – recapitulando un proceso conocido como “transmigración”.
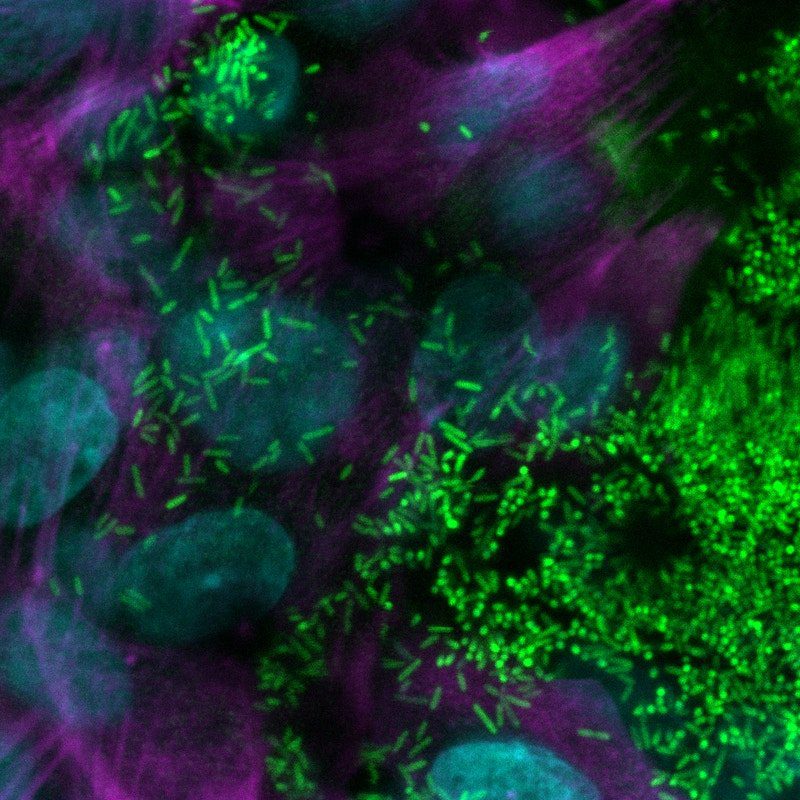
El tejido de las vías respiratorias que imita la fibrosis quística en un chip con su capa de moco secretada apoyó la colonización y el crecimiento del patógeno bacteriano Pseudomonas aeruginosa (mostrado aquí por fluorescencia verde), Pseudomonas aeruginosa, que está presente en el microbioma del pulmón normal pero puede crecen sin control y causan infecciones pulmonares en pacientes humanos con FQ. Crédito: Instituto Wyss de la Universidad de Harvard
Pero el tejido de las vías respiratorias que imita la FQ no solo estimuló el reclutamiento de células inmunitarias, sino que también apoyó el crecimiento de la bacteria, Pseudomonas aeruginosa , que está presente en el microbioma del pulmón normal pero que puede crecer sin control y causar infecciones pulmonares en pacientes humanos con FQ. Veinticuatro horas después de que introdujeron una versión marcada con fluorescencia de P. aeruginosa en el canal de las vías respiratorias de chips creados con células epiteliales bronquiales de pacientes con FQ, el equipo detectó un mayor número del patógeno en el moco específico de la FQ que en el moco de los chips sanos de las vías respiratorias. . Como consecuencia, los niveles de citocinas proinflamatorias aumentaron aún más, replicando así el ciclo de infección-inflamación observado en pacientes con FQ. WYSS , Fibrosis quística WYSS , Fibrosis quística WYSS , Fibrosis quística
Como próximos pasos, el equipo personalizará aún más su chip de vías respiratorias pulmonares para FQ mediante la generación de versiones en las que las células epiteliales bronquiales, endoteliales vasculares e inmunes se obtienen del mismo paciente. “Para este estudio de prueba de concepto, solo hemos utilizado células de las vías respiratorias bronquiales específicas de la FQ de pacientes portadores de la mutación frecuente ΔF508 CFTR. Pero diferentes mutaciones de CFTR también pueden afectar la función de las células endoteliales e inmunes y difieren en sus efectos ”, dijo el coautor Roberto Plebani, Ph.D. “Al desarrollar un panel de chips de vías respiratorias específicos para cada paciente utilizando células de pacientes con diferentes mutaciones, y también midiendo directamente la actividad de los canales iónicos CFTR comprometidos de manera diferente en el chip, las respuestas y la eficacia de los fármacos podrían investigarse de una manera altamente personalizada. ”Plebani trabajó en el laboratorio de Ingber como profesor invitado de la“ G. d’Annnunzio ”de la Universidad de Chieti-Pescara en Italia, y encabezó el proyecto en el grupo de Ingber con Potla.
Otros autores del estudio fueron miembros anteriores y actuales del equipo de Ingber, incluidos Mercy Soong, Haiqing Bai, Ph.D., Zohreh Izadifar, Ph.D., Amanda Jiang, Renee Travis, Chaitra Belgur, Alexandre Dinis, Mark Cartwright, Ph. .D., Rachelle Prantil-Baun, Ph.D., Pawan Jolly, Ph.D. y Sarah Gilpin, Ph.D .; y Mario Romano, Ph.D. y Profesor de la “G. d’Annnunzio ”Universidad de Chieti-Pescara en Italia. El estudio fue financiado por la Cystic Fibrosis Foundation, el Wyss Institute for Biological Inspired Engineering de Harvard y el Program Operativo Nazionale Ricerca e Innovazione.



