
Una vacuna viable para tumores difíciles
La vacuna contra el cáncer basada en biomateriales combina quimioterapia e inmunoterapia para tratar el cáncer de mama triple negativo en ratones
Por Lindsay Brownell 10 de noviembre de 2020

(BOSTON) – Los pacientes con cáncer tienen hoy en día múltiples opciones de tratamiento disponibles, pero cada una tiene sus inconvenientes. La quimioterapia destruye las células cancerosas que se dividen rápidamente, pero también daña las células sanas del cuerpo y, a menudo, no previene eficazmente la metástasis tumoral o la recurrencia de la enfermedad. Las inmunoterapias evitan esos problemas actuando sobre el sistema inmunológico del paciente para generar una respuesta anticancerígena sostenida, pero con frecuencia tienen problemas para acceder a los tumores debido al entorno local inmunosupresor que crean los tumores.

Hua Wang, Ph.D., – Instituto Wyss
Ahora, un nuevo enfoque, lo mejor de ambos mundos, empaqueta el poder de la quimioterapia para matar el cáncer y la eficacia a largo plazo de la inmunoterapia en una vacuna contra el cáncer basada en biomateriales que se puede inyectar junto al sitio del tumor. Cuando se administró la vacuna a ratones con cáncer de mama triple negativo (TNBC) agresivo, el 100% de ellos sobrevivió a una inyección posterior de células cancerosas sin recaer. Esta investigación se informa en Nature Communications .
“El cáncer de mama triple negativo no estimula respuestas fuertes del sistema inmunológico y las inmunoterapias existentes no han logrado tratarlo. En nuestro sistema, la inmunoterapia atrae numerosas células inmunes al tumor, mientras que la quimioterapia produce una gran cantidad de fragmentos de células cancerosas muertas que las células inmunitarias pueden recoger y utilizar para generar una respuesta eficaz específica del tumor ”, dijo el coautor Hua. Wang, Ph.D., ex becario de posdoctorado y desarrollo tecnológico en el Instituto Wyss de Ingeniería de Inspiración Biológica de Harvard y en la Escuela John A. Paulson de Ingeniería y Ciencias Aplicadas (SEAS), que ahora es profesor asistente en el Departamento de Ciencia e Ingeniería de Materiales en la Universidad de Illinois, Urbana-Champaign.
Vacunas personalizadas sin esperas
Desarrollada por primera vez en 2009, la vacuna inyectable contra el cáncer se ha mostrado muy prometedora en el tratamiento de múltiples tipos de cáncer en ratones y se ha explorado en ensayos clínicos para el tratamiento del melanoma en el Instituto del Cáncer Dana Farber. En la formulación original de la vacuna, las moléculas que se encuentran en las células cancerosas llamadas antígenos asociados a tumores (TAA) se incorporaron junto con adyuvantes dentro del andamio del tamaño de una aspirina para que las células dendríticas que llegan pudieran reconocerlas como “extrañas” y montar una respuesta inmune dirigida. contra el tumor. Estos TAA pueden aislarse de tumores recolectados o identificarse secuenciando el genoma de células cancerosas y posteriormente fabricados, pero ambos procesos para crear vacunas contra el cáncer personalizadas pueden ser largos, tediosos y costosos.

alex-najibi-facultad-de-wyss-
“Uno de los factores limitantes críticos en el desarrollo de vacunas contra el cáncer es la selección de TAA, porque actualmente solo tenemos una biblioteca muy pequeña de antígenos conocidos para unas pocas líneas de células tumorales específicas, y es difícil predecir cuál puede montar un sistema inmunológico eficaz respuesta ”, dijo el coautor Alex Najibi, un estudiante de posgrado en el laboratorio del miembro de la Facultad de Wyss Core, David Mooney . “La implantación de fármacos de quimioterapia dentro del andamio de la vacuna crea una explosión de muerte de células cancerosas que libera TAA directamente desde el tumor a las células dendríticas, sin pasar por el largo y costoso proceso de desarrollo de antígenos”.

David Mooney
Wang, Najibi y sus colegas se propusieron aplicar esta nueva táctica de vacuna contra el cáncer al TNBC, una enfermedad en la que los tumores suprimen agresivamente la actividad inmune en su área local, lo que limita la eficacia de la inmunoterapia. El equipo primero cargó su andamio de hidrogel de alginato con una molécula de proteína llamada factor estimulante de colonias de granulocitos y macrófagos (GM-CSF). El GM-CSF estimula el desarrollo y la concentración de células dendríticas, que captan antígenos de tumores y otros invasores y los presentan a las células T en los ganglios linfáticos y el bazo para iniciar una respuesta inmunitaria. También agregaron el fármaco de quimioterapia doxorrubicina (Dox) unido a un péptido llamado iRGD. Se sabe que iRGD penetra en los tumores y ayuda a dirigir el Dox a los tumores una vez liberado.
Cuando se inyectó la nueva vacuna a ratones con tumores TNBC, los que recibieron un andamio cargado con GM-CSF y el conjugado Dox-iRGD mostraron una penetración significativamente mejor del fármaco en los tumores, aumento de la muerte de las células cancerosas y menos tumores metastásicos en los pulmones. que los que recibieron geles que contenían Dox conjugado con una molécula de péptido revuelto, Dox sin modificar o no fueron tratados. El análisis de los andamios mostró que habían acumulado una gran cantidad de células dendríticas, lo que indica que tanto los componentes de inmunoterapia como de quimioterapia de la vacuna estaban activos.
Animado por estos resultados, el equipo experimentó con la adición de un tercer componente a la vacuna llamado CpG, una secuencia de ADN bacteriano sintético que se sabe que mejora las respuestas inmunes. Los ratones que recibieron vacunas con esta adición mostraron un crecimiento tumoral significativamente más lento y tiempos de supervivencia más largos que los ratones que recibieron vacunas sin ella. Para evaluar la fuerza y la especificidad de la respuesta inmune generada por esta vacuna de tres partes, los investigadores extrajeron y analizaron células de los ganglios linfáticos y el bazo de los animales. Sorprendentemente, el 14% de las células T extraídas de los ganglios linfáticos reaccionaron contra las células tumorales, lo que indica que las células dendríticas las “entrenaron” para atacar el cáncer, en comparación con solo el 5,3% de los ratones que recibieron la vacuna de dos partes. y el 2,4% de las células T de ratones no tratados. Adicionalmente,
Acción localizada, protección a largo plazo

Si bien estos resultados revelaron el efecto de la vacuna sobre la activación del sistema inmunológico, el equipo también quería comprender cómo afectaba el microambiente local del tumor. El análisis de las vacunas y sus tumores cercanos reveló que las células de los tumores tratados con geles que contienen GM-CSF, Dox-iRGD y CpG tenían una mayor cantidad de la proteína calreticulina en sus superficies, que es un indicador de muerte celular. Los ratones que recibieron la vacuna de tres partes también mostraron un mayor número de macrófagos proinflamatorios: glóbulos blancos que se asocian con una actividad anticancerígena mejorada y una supervivencia más prolongada.
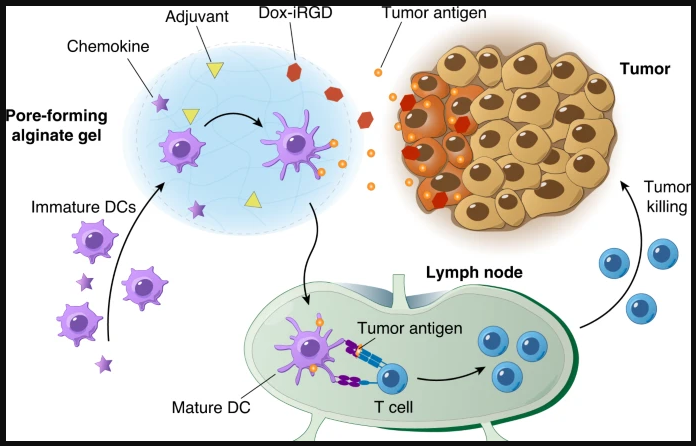
El biomaterial se inyecta peritumoralmente y se libera Dox-iRGD para penetrar en los tumores e inducir la muerte inmunogénica de las células tumorales, mientras que las quimiocinas liberadas pueden acumular un gran número de células dendríticas (DC) inmaduras en el sitio del andamio. Las CD acumuladas pueden absorber y procesar antígenos tumorales mientras se activan con adyuvantes para cebar las células T específicas del tumor para la muerte de las células tumorales.
Los investigadores también descubrieron que su tratamiento provocó un aumento en la expresión de la proteína de la superficie celular PD-L1 en las células tumorales, que el cáncer utiliza para evadir la detección inmunitaria. Tenían el presentimiento de que la coadministración de un tratamiento inhibidor del punto de control anti-PD-1 que bloquea esta evasión inmune con su vacuna aumentaría su efectividad. Implantaron la vacuna de tres partes en ratones, luego inyectaron anti-PD-1 por separado. Los ratones tratados con la combinación de la vacuna en gel y anti-PD-1 mostraron un tamaño y número de tumores significativamente reducidos, y sobrevivieron una mediana de 40 días en comparación con 27 días para los ratones no tratados y 28 días para los ratones que recibieron anti-PD-1 solo. . Esta sinergia sugirió que la vacuna podría usarse mejor en combinación con terapias con inhibidores de puntos de control.
Para imitar cómo se podría administrar la vacuna contra el cáncer a pacientes humanos, el equipo probó su capacidad para prevenir la recurrencia del cáncer después de la extirpación de un tumor primario. Ellos extirparon quirúrgicamente los tumores TNBC de ratones, luego inyectaron su vacuna de hidrogel de tres partes o una vacuna líquida que contenía todos los componentes en una suspensión cerca del sitio original del tumor. Ambos grupos tratados tuvieron una recurrencia tumoral significativamente menor, pero la vacuna en gel produjo un crecimiento tumoral significativamente más lento y mejoró la supervivencia. Luego, los ratones fueron reexpuestos con una inyección de células cancerosas y, sorprendentemente, el 100% de los ratones que habían recibido la vacuna en gel sobrevivieron sin metástasis, mientras que todos los ratones no tratados sucumbieron a la enfermedad.
“ La capacidad de esta vacuna para provocar respuestas inmunes potentes sin requerir la identificación de antígenos específicos del paciente es una gran ventaja, al igual que la capacidad de la administración de quimioterapia local para evitar los efectos secundarios graves de la quimioterapia sistémica, el único tratamiento disponible actualmente para la enfermedad ”, dijo el autor correspondiente Mooney, Ph.D., quien dirige la plataforma Immuno-Materials en el Instituto Wyss y también es el Profesor de Bioingeniería de la Familia Robert P. Pinkas en SEAS. “Esta vacuna no solo activa las células dendríticas con TAA específicos del tumor in situ , sino que también modifica el microambiente del tumor para permitir que el sistema inmunológico tenga un mayor acceso al tumor y crea una memoria inmunitaria que previene más recurrencias”.

Don Ingber ,Wyss Institute,
El equipo continúa explorando la combinación de quimioterapia con vacunas contra el cáncer y espera mejorar su eficacia antitumoral para otros modelos tumorales difíciles de tratar. El equipo espera que los estudios futuros para comprender mejor y optimizar el sistema le permitan pasar a ensayos preclínicos y, finalmente, a pacientes humanos.
“La versión más reciente del equipo de su vacuna contra el cáncer es una nueva terapia multifuncional contra el cáncer que ofrece nuevas esperanzas para el tratamiento de una amplia gama de cánceres. Es esencialmente una forma completamente nueva de quimioterapia combinada que se puede administrar a través de una sola inyección y potencialmente ofrecer una mayor eficacia con una toxicidad mucho menor que los tratamientos convencionales que se usan en la actualidad ”, dijo el director fundador del Wyss Institute, Don Ingber , MD, Ph.D. Ingber también es profesor Judah Folkman de Biología Vascular en la Facultad de Medicina de Harvard y del Programa de Biología Vascular en el Boston Children’s Hospital, así como profesor de Bioingeniería en SEAS.
Los autores adicionales del artículo incluyen a los miembros de Wyss y SEAS, Miguel Sobral, Bo Ri Seo, Ph.D., David Wu, DMD y Catia Verbeke, Ph.D., y los ex miembros Jun Yong Lee, Ph.D., quien es ahora es profesora asistente en la Universidad Católica de Corea, y Aileen Li, Ph.D., que ahora es becaria postdoctoral en la Universidad de California, San Francisco.
Este trabajo fue apoyado por los Institutos Nacionales de Salud, la Beca de Desarrollo Tecnológico Wyss y la Fundación Nacional de Ciencias.
- TECNOLOGÍA WYSS – Vacuna implantable contra el cáncer
- PUBLICACIÓN – Nature Communications : andamio basado en biomateriales para quimioinmunoterapia in situ para tratar tumores pobremente inmunogénicos


