IRB Barcelona , La capacidad biosintética, clave para erradicar las células madre tumorales
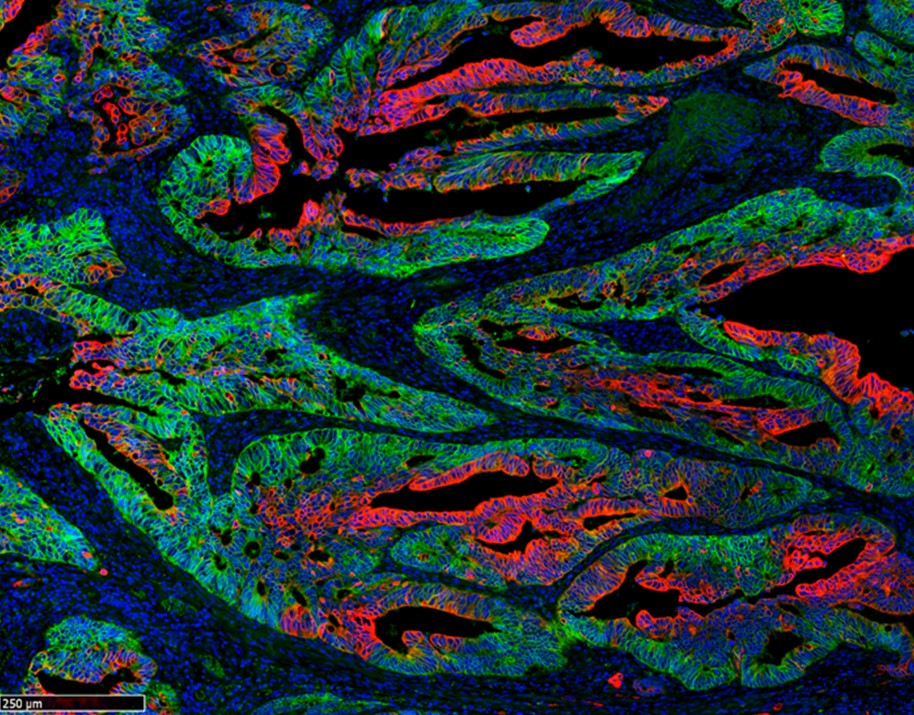 La heterogeneidad del tumor: células madre cancerosas (verde) y células diferenciadas (en rojo). IRB Barcelona.
La heterogeneidad del tumor: células madre cancerosas (verde) y células diferenciadas (en rojo). IRB Barcelona.
12 MAY 2020
El laboratorio de Cancer Colorrectal del IRB Barcelona identifica la síntesis de proteínas (o capacidad biosintética) como propiedad clave para la potencialidad regeneradora de las células del cáncer de colon. La capacidad biosintética, clave para erradicar las células madre tumorales La capacidad biosintética, clave para erradicar las células madre tumorales
El trabajo, publicado en Cell Stem Cell, propone un nuevo enfoque terapéutico que la comunidad científica y las farmacéuticas deberán explorar.
Los tumores no son una masa uniforme de células. En el cáncer de colon encontramos células diferenciadas, parecidas a las células funcionales propias de la pared intestinal, y células pluripotentes, las células madre del tumor. Estas células pluripotentes mantienen el crecimiento tumoral y son las causantes de las metástasis. Un grupo de investigadores liderado por , jefe de grupo en el CIBER de Cáncer (CIBERONC), y jefe del laboratorio de Cáncer Colorrectal del IRB Barcelona, ha demostrado que la esencia de la pluripotencialidad reside en la capacidad de sintetizar proteínas, una propiedad que se podría utilizar como diana terapéutica.

Eduard Batlle, investigador ICREA
“Las terapias actuales contra el cáncer de colon no son eficaces porque no logran eliminar todas las células pluripotentes. Varios grupos de investigación, incluido el nuestro, hemos observado que incluso cuando se eliminan las células madre del cáncer mediante estrategias experimentales, algunas células diferenciadas pueden regresar al estado original pluripotente y regenerar el tumor. Es un fenómeno al que llamamos plasticidad celular”, explica Batlle.
En este trabajo, el grupo de Cáncer Colorrectal del IRB Barcelona ha observado que la síntesis de proteínas en los tumores, tiene lugar en regiones concretas, que coinciden con los nichos de las células madre del tumor. De hecho, los tumores muestran un gradiente de producción de proteínas y, una vez esta actividad se agota, las células pierden de manera irreversible la capacidad de volver al estado de célula madre del cáncer. Por lo tanto, es la capacidad biosintética la que permite a las células madre del tumor contribuir de forma ilimitada al crecimiento tumoral.
“Este descubrimiento va dirigido a intentar erradicar las células madre del cáncer basándonos en lo que hacen, y no tanto en lo que son” explica Batlle. “A partir de estos datos, la comunidad científica y farmacéutica se podrá plantear si es posible diseñar y ensayar maneras de interferir terapéuticamente con la capacidad biosintética en las células madre tumorales para frenar el crecimiento de los tumores y prevenir las metástasis”, añade.
Bloquear la capacidad biosintética detiene el crecimiento del tumor

Clara Morral,
“Utilizando modelos de cáncer de colon en ratones, observamos que bloqueando la capacidad de producir proteínas o eliminando las células tumorales con esta propiedad, conseguimos frenar el crecimiento del tumor de forma irreversible. Ahora el siguiente paso es estudiar las señales del entorno tumoral que confieren o mantienen la capacidad biosintética a ciertas células del tumor” explica Clara Morral, primera autora del artículo.
Organoides i CRISPR, claves para una investigación exitosa
El trabajo se ha llevado a cabo utilizando organoides, mini-tumores derivados de pacientes y cultivables en el laboratorio, que permiten estudiar la heterogeneidad y organización celular de los tumores. El sistema de organoides, es una herramienta importante para recrear los tumores de los pacientes y estudiar mejor la biología del cáncer y su interacción con los tejidos. El estudio también ha requerido la modificación genética de las células tumorales mediante la técnica de CRISPR-Cas9. Esta técnica ha permitido eliminar específicamente las células con capacidad biosintética para evaluar su contribución al crecimiento del tumor.
El estudio se ha realizado con la colaboración de los grupos de Scott Lowe, del Memorial Sloan Kettering Cancer Center, Lukas Dow del Weill-Cornell Medical College en New York, Alberto Villanueva del IDIBELL y Holger Heyn del CNAG-CRG. Este trabajo ha sido posible gracias a la financiación de ERC Advanced Grant, Worlwide Cancer Research Grant y AGAUR; y becas a investigadores de los programas de La Caixa, Miguel Servet, Juan de la Cierva y AECC.
Artículo de referencia:
Clara Morral, Jelena Stanisavljevic, XavierHernando-Momblona, Elisabetta Mereu, Adrián Álvarez-Varela, CarmeCortina, Diana Stork, Felipe Slebe, Gemma Turon, Gavin Whissell, Marta Sevillano, Anna Merlos-Suárez, Àngela Casanova-Martí, Catia Moutinho, Scott W. Lowe, Lukas E. Dow, Alberto Villanueva, Elena Sancho, Holger Heyn, & Eduard Batlle
Zonation of Ribosomal DNA Transcription Defines a Stem Cell Hierarchy in Colorectal Cancer
Cell Stem Cell (2020) doi: 10.1016/j.stem.2020.04.012
Sobre el IRB Barcelona
Creado en 2005 por la Generalitat de Catalunya y la Universidad de Barcelona, el IRB Barcelona es Centro de Excelencia Severo Ochoa desde 2011. El objetivo del IRB Barcelona es hacer investigación de excelencia en biomedicina y mejorar la calidad de vida de las personas y, en paralelo, potenciar la formación de talento, la transferencia tecnológica y la comunicación social de la ciencia. Los 25 laboratorios y siete plataformas tecnológicas trabajan para responder a preguntas básicas en biología y orientadas a enfermedades como el cáncer, la metástasis, el Alzheimer, la diabetes y enfermedades raras. Es un centro internacional que acoge alrededor de 400 trabajadores de 32 nacionalidades. Está ubicado en el Parque Científico de Barcelona. El IRB Barcelona forma parte del Barcelona Institute of Science and Technology (BIST) y la red de Centros de Investigación de Catalunya (CERCA).
UC3M, sistema de radiografías de alta precisión para el coronavirus

