Cómo hacer que los hidrogeles sean más inyectables

Un nuevo marco computacional podría ayudar a los investigadores a diseñar hidrogeles granulares para reparar o reemplazar tejidos enfermos.
- Los materiales similares a gel que se pueden inyectar en el cuerpo tienen un gran potencial para curar tejidos lesionados o fabricar tejidos completamente nuevos.
- Muchos investigadores están trabajando para desarrollar estos hidrogeles para usos biomédicos, pero hasta ahora muy pocos han llegado a la clínica.
Para ayudar a guiar el desarrollo de dichos materiales, que están hechos de bloques de construcción a microescala similares a los blandos LEGO, los investigadores del MIT y la Universidad de Harvard han creado un conjunto de modelos computacionales para predecir la estructura del material, las propiedades mecánicas y los resultados de rendimiento funcional. Los investigadores esperan que su nuevo marco pueda facilitar el diseño de materiales que se puedan inyectar para diferentes tipos de aplicaciones, que hasta ahora ha sido principalmente un proceso de prueba y error.
“Es realmente emocionante desde el punto de vista de los materiales y de la aplicación clínica”, dice Ellen Roche, profesora asociada de ingeniería mecánica y miembro del Instituto de Ingeniería y Ciencias Médicas del MIT.
“En términos más generales, es un buen ejemplo de tomar datos de laboratorio y sintetizarlos en algo utilizable que pueda brindarle pautas predictivas que podrían aplicarse a cosas más allá de estos hidrogeles”.
Roche y Jennifer Lewis, profesora Hansjörg Wyss de Ingeniería Biológicamente Inspirada en Harvard, son los autores principales del estudio, que aparece hoy en la revista Matter . Connor Verheyen, estudiante graduado en el Programa Harvard-MIT en Ciencias y Tecnología de la Salud, es el autor principal del artículo .
Modelado de materiales
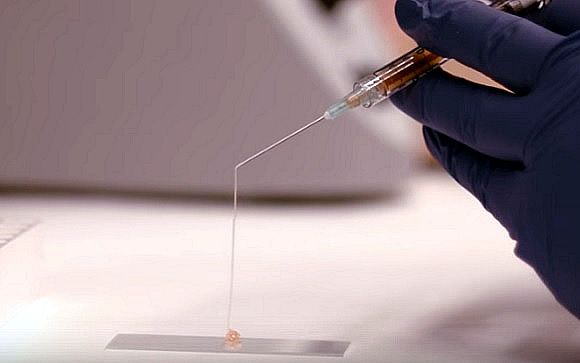
Cuando los bloques de hidrogel individuales se compactan densamente, forman un material similar a un gel conocido como matriz granular. Estos materiales pueden actuar como sólidos o líquidos, según las condiciones, lo que los convierte en buenos candidatos para aplicaciones como la bioimpresión de tejidos de ingeniería en 3D. Una vez inyectados o implantados en el cuerpo, podrían liberar fármacos o ayudar a regenerar el tejido lesionado.
“Estos materiales tienen mucha flexibilidad y capacidad de personalización, por lo que hay mucho interés en usarlos para aplicaciones biomédicas”, dice Verheyen.
Mientras trabajaba en el laboratorio de Lewis, Verheyen, coasesorado por Lewis y Roche, comenzó a tratar de descubrir cómo hacer que estos materiales fueran inyectables de manera confiable. Esto resultó ser una tarea difícil que requirió mucha experimentación de prueba y error, cambiando diferentes características de los geles con la esperanza de optimizar su estructura y comportamiento mecánico para la inyectabilidad.
“Eso estimuló el esfuerzo de tomar los datos empíricos, convertirlos en algo que una máquina pudiera leer y trabajar, y luego pedirle que construyera un mapa predictivo que pudiéramos interrogar para ayudarnos a comprender qué estaba pasando y cómo ir a el siguiente paso”, dice.
Para crear su marco de diseño, los investigadores dividieron el proceso de ensamblaje en varias etapas. Modelaron cada una de estas etapas por separado, utilizando datos de sus propios experimentos, que se realizaron en una variedad de condiciones diferentes.
En la primera etapa, el modelo analizó cómo las propiedades de los biobloques se ven afectadas por el material de partida de los bloques y cómo se ensamblan. En la segunda etapa, los biobloques se juntan para formar estructuras llamadas “hidrogeles granulares”. A través de su modelado, los investigadores identificaron varios factores que influyen en la inyectabilidad del gel final, incluidos el tamaño y la rigidez de los biobloques, la viscosidad del líquido intersticial entre los bloques y las dimensiones de la aguja y la jeringa utilizadas para inyectar el gel. .
Mejor inyectabilidad
Ahora que han modelado el proceso de principio a fin, los investigadores pueden usar su modelo para predecir la mejor manera de crear un material con las características que necesitan para una aplicación en particular, en lugar de pasar por un extenso proceso de prueba y error para cada material nuevo.
“Nuestro objetivo a largo plazo era llegar al punto en que tuviéramos propiedades de inyección confiables y predecibles, porque eso era algo con lo que realmente tuvimos problemas en el laboratorio: lograr que estos materiales fluyan correctamente”, dice Verheyen.
Él y otros en el laboratorio de Roche ahora planean usar este enfoque de modelado para tratar de desarrollar materiales que podrían usarse para aplicaciones médicas, como :
reparar defectos cardíacos o administrar medicamentos al tracto gastrointestinal.
Los investigadores también han hecho que sus modelos y los datos que usaron para generarlos estén disponibles en línea para que los usen otros laboratorios.
“Todo es de código abierto y, con suerte, reducirá la cantidad de frustración con los problemas que podría tener al reproducir algo que sucedió en otro laboratorio, o incluso dentro de un laboratorio cuando está transfiriendo conocimiento de una persona a otra”, dice Roche.
La investigación fue financiada por el Programa de Becas de la Facultad Vannevar Bush, la Fundación Nacional de Ciencias y una subvención del Fondo Semilla de MathWorks.
Relacionado Nuve :
https://revistanuve.com/grafeno-para-ingenieria-regenerativa/
Un tejido sintético puede reparar corazones, músculos y curar heridas