La nueva comprensión de cómo las características mecánicas de la médula ósea afectan a las células inmunitarias residentes en el cáncer fibrótico apunta a futuras estrategias terapéuticas para el cáncer y las enfermedades fibróticas.
Por Benjamin Boettner
(BOSTON) — La fibrosis es el engrosamiento de varios tejidos causado por el depósito de matriz extracelular fibrilar (MEC) en tejidos y órganos como parte de la respuesta de curación de heridas del cuerpo a diversas formas de daño. Cuando se acompaña de inflamación crónica, la fibrosis puede acelerarse y producir un exceso de tejido cicatricial que ya no se puede degradar.
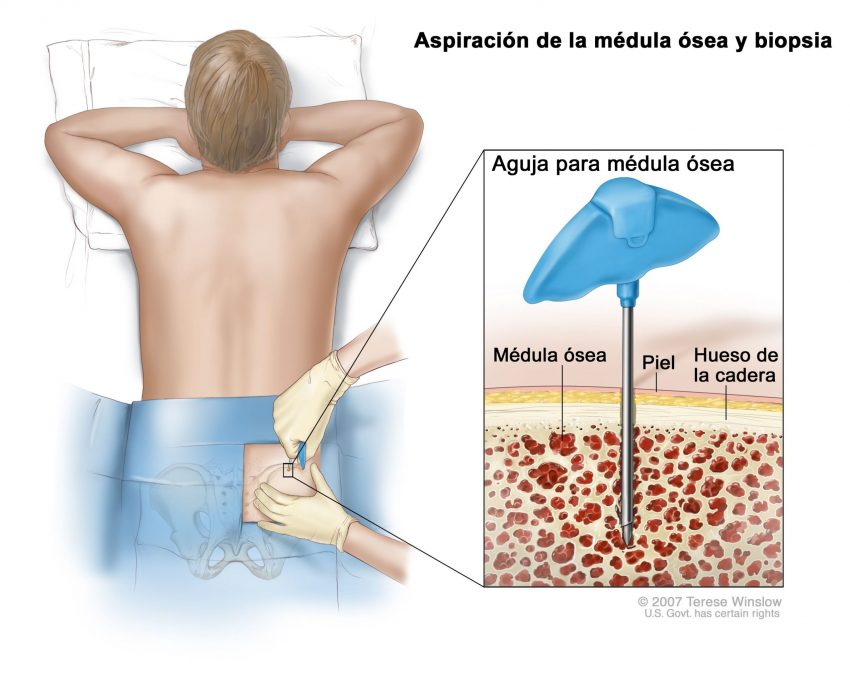
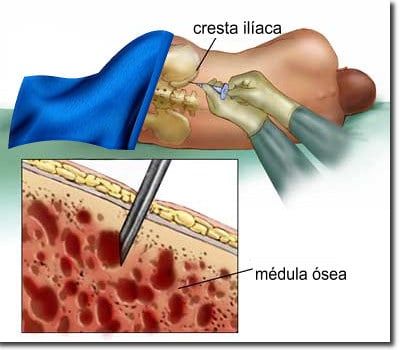
Este proceso causa muchas enfermedades en múltiples órganos, incluida la fibrosis pulmonar inducida por el tabaquismo o el asbesto, la fibrosis hepática inducida por el abuso del alcohol y la fibrosis cardíaca a menudo después de un ataque al corazón. La fibrosis también puede ocurrir en la médula ósea (BM), el tejido esponjoso dentro de algunos de nuestros huesos que alberga células madre hematopoyéticas (HSC) productoras de sangre, lo que provoca cicatrices y la interrupción de las funciones normales.
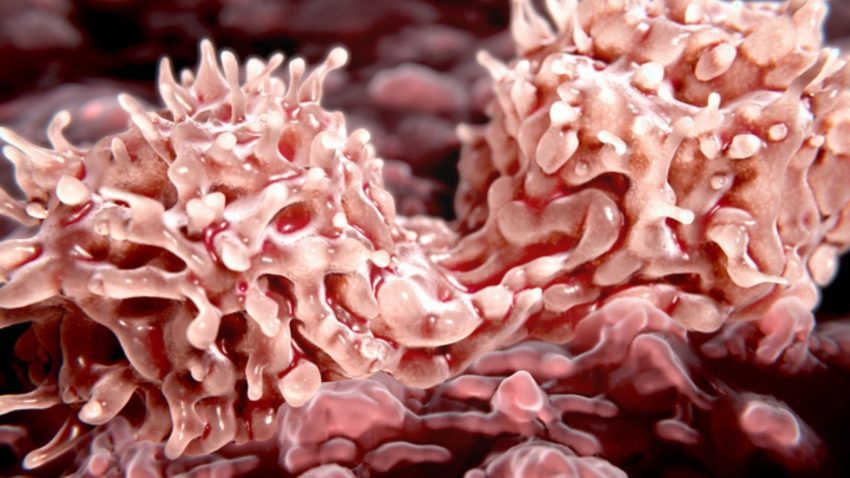
Un ejemplo son los cánceres sanguíneos crónicos conocidos como “ neoplasias mieloproliferativas ” (MPN), en los que los pacientes pueden desarrollar BM fibrótico (mielofibrosis) que interrumpe la producción normal de células sanguíneas. Los monocitos, un tipo de glóbulo blanco que pertenece al grupo de las células mieloides, se producen en exceso a partir de las HSC en la MPN y contribuyen a la inflamación en el entorno de la MO (nicho). Sin embargo, se desconocía cómo el nicho fibrótico de la médula ósea afecta la función de los monocitos y la inflamación en la médula ósea.

Ahora, un equipo de colaboración en el | del Instituto Wyss Instituto Wyss en Harvard de Ingeniería Biológicamente Inspirada de Harvard en la Universidad de Harvard, la Escuela de Ingeniería y Ciencias Aplicadas John A. Paulson (SEAS), el Instituto del Cáncer Dana-Farber (DFCI) y el Hospital Brigham and Women’s (Brigham), ha creó un modelo in vitro programable basado en hidrogel que imitaba la BM humana sana y fibrótica. Combinando este sistema con ratón in vivomodelos de mielofibrosis (MF), demostraron que los monocitos deciden si entran en un estado proinflamatorio y se diferencian en células dendríticas inflamatorias en función de las propiedades mecánicas específicas del nicho de BM con sus moléculas ECM densamente empaquetadas. Es importante destacar que el equipo descubrió que un fármaco que inhibía la proteína PI3K-gamma atenuó estos efectos mecánicos patológicos en los monocitos y redujo su número, así como el número de células mieloides inflamatorias en ratones con MF. Los hallazgos se publican en Nature Materials .
“Nuestro estudio muestra que el estado de diferenciación de los monocitos, que son actores clave en el sistema inmunológico, está altamente regulado por cambios mecánicos en la ECM que encuentran. Específicamente, la viscoelasticidad de la ECM ha sido un aspecto históricamente subestimado de sus propiedades mecánicas que encontramos que se correlaciona fuertemente entre nuestros modelos in vitro e in vivo y las enfermedades humanas”, dijo el miembro de la facultad de Wyss Core, David Mooney , Ph.D., quien codirigió el estudio con el investigador de DFCI Kai Wucherpfennig , MD, Ph.D. “Resulta que la MF es una enfermedad relacionada con la mecánica que podría tratarse interfiriendo con la señalización mecánica en las células de la médula ósea”, agregó Mooney.
Mooney también es profesor de bioingeniería de la familia Robert P. Pinkas en SEAS y dirige la plataforma de materiales inmunológicos del Instituto Wyss. Wucherpfennig es director del Centro de Investigación de Inmunoterapia del Cáncer de DFCI, profesor de neurobiología en la Escuela de Medicina Brigham and Harvard y miembro asociado del Instituto Broad del MIT y Harvard. Mooney, junto con el coautor principal F. Stephen Hodi , también dirige el Centro de inmunoingeniería para mejorar la inmunoterapia ( i3 ), cuyo objetivo es crear nuevos enfoques basados en biomateriales para mejorar las respuestas inmunitarias contra los tumores. Hodi es Director del Centro de Melanoma y del Centro de Inmuno-Oncología en DFCI, y Profesor de Medicina en la Facultad de Medicina de Harvard (HMS).
Resulta que [la mielofibrosis de la médula ósea] es una enfermedad relacionada con la mecánica que podría tratarse interfiriendo con la señalización mecánica en las células de la médula ósea.
Insuficiencia mecánica de la médula ósea
Las propiedades mecánicas de la mayoría de los materiales biológicos están determinadas por sus características “viscoelásticas”. A diferencia de las sustancias puramente elásticas como el cuarzo vibrante, que almacenan energía elástica cuando se someten a tensión mecánica y recuperan rápidamente su estado original una vez que se elimina la tensión (relajación lenta), las sustancias viscoelásticas también tienen un componente viscoso. Al igual que la viscosidad de la miel, esto les permite disipar el estrés bajo tensión mecánica mediante una rápida relajación del estrés. Los materiales viscosos son, por lo tanto, materiales que se relajan rápidamente en contraste con los materiales puramente elásticos que se relajan lentamente.

El equipo desarrolló un sistema de hidrogel a base de alginato que imita la viscoelasticidad de la ECM natural, lo que les permitió ajustar la elasticidad independientemente de otras propiedades físicas y bioquímicas. Al ajustar el equilibrio entre las propiedades elásticas y viscosas en estas MEC artificiales, podrían recapitular la viscoelasticidad de la MO fibrótica sana y con cicatrices, cuya elasticidad aumenta con el exceso de fibras de MEC. Los monocitos humanos colocados en estos ECM artificiales los empujan y tiran constantemente y, a su vez, responden a las características mecánicas de los materiales.
“Descubrimos que las ECM artificiales rígidas y más elásticas de relajación lenta inducían a los monocitos inmaduros a diferenciarse en monocitos con un programa proinflamatorio muy parecido al de los monocitos en pacientes con MF, y a los monocitos a diferenciarse aún más en células dendríticas inflamatorias. Las ECM artificiales más viscosas y de relajación rápida suprimieron este efecto similar al MF en los monocitos”, dijo el coautor Kyle Vining, Ph.D., quien trabajó como becario postdoctoral en el equipo de Mooney. “Esto abrió la posibilidad de un punto de control mecánico que podría interrumpirse en la médula ósea mielofibrótica y también puede estar en juego en otras enfermedades fibróticas”. Vinning es ahora Profesor Asistente de Ciencias Preventivas y Restaurativas en la Universidad de Pensilvania.
A continuación, el equipo investigó cómo se comparan las características mecánicas de los hidrogeles rígidos y elásticos con las de la BM real afectada por la MF. Aprovecharon un modelo de ratón en el que una mutación activadora en un gen conocido como Jak2 causa MPN, señalización proinflamatoria en la BM y desarrollo de MF, similar al proceso de la enfermedad en pacientes humanos con MPN. Cuando investigaron las propiedades mecánicas de la MO en los huesos del fémur de los animales, utilizando una sonda de nanoindentación, los investigadores midieron una mayor rigidez que en la MO no fibrótica. “Es importante destacar que descubrimos que la clasificación patológica de MF en el modelo animal se correlacionó significativamente con los cambios en la viscoelasticidad”, dijo la coautora Anna Marneth., Ph.D., quien encabezó los experimentos en el modelo de ratón como becaria postdoctoral trabajando con Ann Mullally , MD, investigadora principal en Brigham and DFCI, y otra autora principal del estudio.
Apuntando a la mecánica desregulada de la médula ósea
Una pregunta importante era si la respuesta de los monocitos al impacto mecánico del nicho fibrótico de la MO podría ser un objetivo terapéutico. Los investigadores se centraron en una isoforma de la proteína gamma fosfoinositida 3-quinasa (PI3K), que se expresa específicamente en monocitos y células inmunitarias estrechamente relacionadas. PI3K-gamma es conocido por regular el ensamblaje de un citoesqueleto filamentoso que endurece las células debajo de la superficie celular y que se expande en respuesta al estrés mecánico, que el equipo también observó en los monocitos que se encuentran con una MEC fibrótica. De hecho, cuando agregaron un fármaco que inhibe PI3K-gamma a las MEC artificiales elásticas rígidas, disminuyó su respuesta proinflamatoria y, cuando se administró como tratamiento oral a ratones MF, redujo significativamente la cantidad de monocitos y células dendríticas en su BM. .
Esta investigación abre nuevas vías para modificar la función de las células inmunitarias en enfermedades fibróticas que actualmente son difíciles de tratar. Los resultados también son muy relevantes para los cánceres humanos con un microambiente altamente fibrótico, como el cáncer de páncreas.
“Esta investigación abre nuevas vías para modificar la función de las células inmunitarias en enfermedades fibróticas que actualmente son difíciles de tratar. Los resultados también son muy relevantes para los cánceres humanos con un microambiente altamente fibrótico, como el cáncer de páncreas”, dijo Wucherpfennig.
“Este estudio es un gran avance en la interfaz entre la inmunología y la mecanobiología, que muestra cómo enfocarse en el entorno mecánico de un tejido, en lugar de los fundamentos genéticos de la enfermedad, puede permitir potencialmente una nueva generación de poderosas intervenciones terapéuticas”, dijo Wyss Founding. Director Donald Ingber , MD, Ph.D., quien también es profesor Judah Folkman de Biología Vascular en la Facultad de Medicina de Harvard y el Hospital Infantil de Boston, y profesor Hansjörg Wyss de Ingeniería Bioinspirada en la Facultad de Ingeniería y Ciencias Aplicadas John A. Paulson de Harvard .
Relacionado Nuve :
Wyss: Nikolaos Dimitrakakis la médula ósea artificial Revista NUVE
UR – exoesqueleto para pacientes con lesiones de médula ósea