La inmunoterapia muestra potencial en el tratamiento de la fibrosis pulmonar
Una nueva investigación sugiere que la fibrosis pulmonar se desarrolla cuando las células del tejido cicatricial escapan de la vigilancia inmune, lo que sugiere una terapia potencial.
24 de Junio 2020
La fibrosis pulmonar idiopática es una enfermedad debilitante con un pronóstico sombrío. Es causada por cicatrices progresivas en los pulmones, lo que dificulta la respiración y los pacientes se vuelven dependientes del oxígeno. El tratamiento de la enfermedad es un desafío porque no está claro por qué comienza y se extiende la cicatrización.

Gerlinde Wernig
Ahora, un equipo de investigadores dirigido por el profesor asistente de patología Gerlinde Wernig, MD, del Instituto Stanford de Biología de Células Madre y Medicina Regenerativa , ha demostrado que las células de tejido cicatricial llamadas fibroblastos pueden proliferar al evitar la vigilancia inmunológica, al igual que las células cancerosas. Una terapia puede consistir en reactivar esa función inmune.
La vigilancia inmune es el proceso que el cuerpo usa para mantener los tejidos sanos y eliminar las células que pueden causar enfermedades. Por ejemplo, las células inmunes errantes detectan y eliminan las células precancerosas. Las células cancerosas más avanzadas pueden resistir este proceso al presentar señales moleculares protectoras.
Una de estas proteínas protectoras de señalización, CD47, es utilizada por las células cancerosas como una señal de “no me comas” que detiene las células inmunes llamadas macrófagos de las células devoradoras. Otro, llamado PD-L1, a veces lo usan las células aberrantes para evitar que los macrófagos y otras células inmunes llamadas células T los ataquen.
“En la enfermedad pulmonar idiopática, estos fibroblastos se comportan casi como células cancerosas”, dijo Wernig. “Crecen sobre las estructuras pulmonares normales, borrando las vías respiratorias y bloqueando el paso del aire dentro y fuera de la sangre”. Al igual que las células cancerosas, descubrió Wernig, los fibroblastos también evaden el sistema inmunitario utilizando estas proteínas que amortiguan el sistema inmunitario.
En trabajos anteriores, Wernig y sus colegas demostraron que un gen llamado JUN es un regulador maestro de los procesos fibróticos en ratones. La expresión del gen causó fibrosis de pulmón, hígado, piel, médula ósea y riñón en ratones. En el trabajo actual, Wernig y sus colegas demostraron que en muestras de tejido de pacientes con fibrosis pulmonar en etapa terminal, JUN activa directamente los genes para CD47 y PD-L1, lo que lleva a una mayor producción de estas proteínas en las células pulmonares formadoras de cicatrices fibróticas.

Cuando los investigadores bloquearon la señalización de IL-6 y CD47 simultáneamente, el tratamiento mejoró drásticamente el tejido pulmonar en ratones al aumentar la eliminación de células fibróticas. “En ratones, con el bloqueo combinado de la inflamación y la señal de ‘no me comas’, pudimos eliminar la fibrosis establecida en etapa terminal”, dijo Wernig.
El trabajo fue publicado en línea en Nature Communications en junio.:
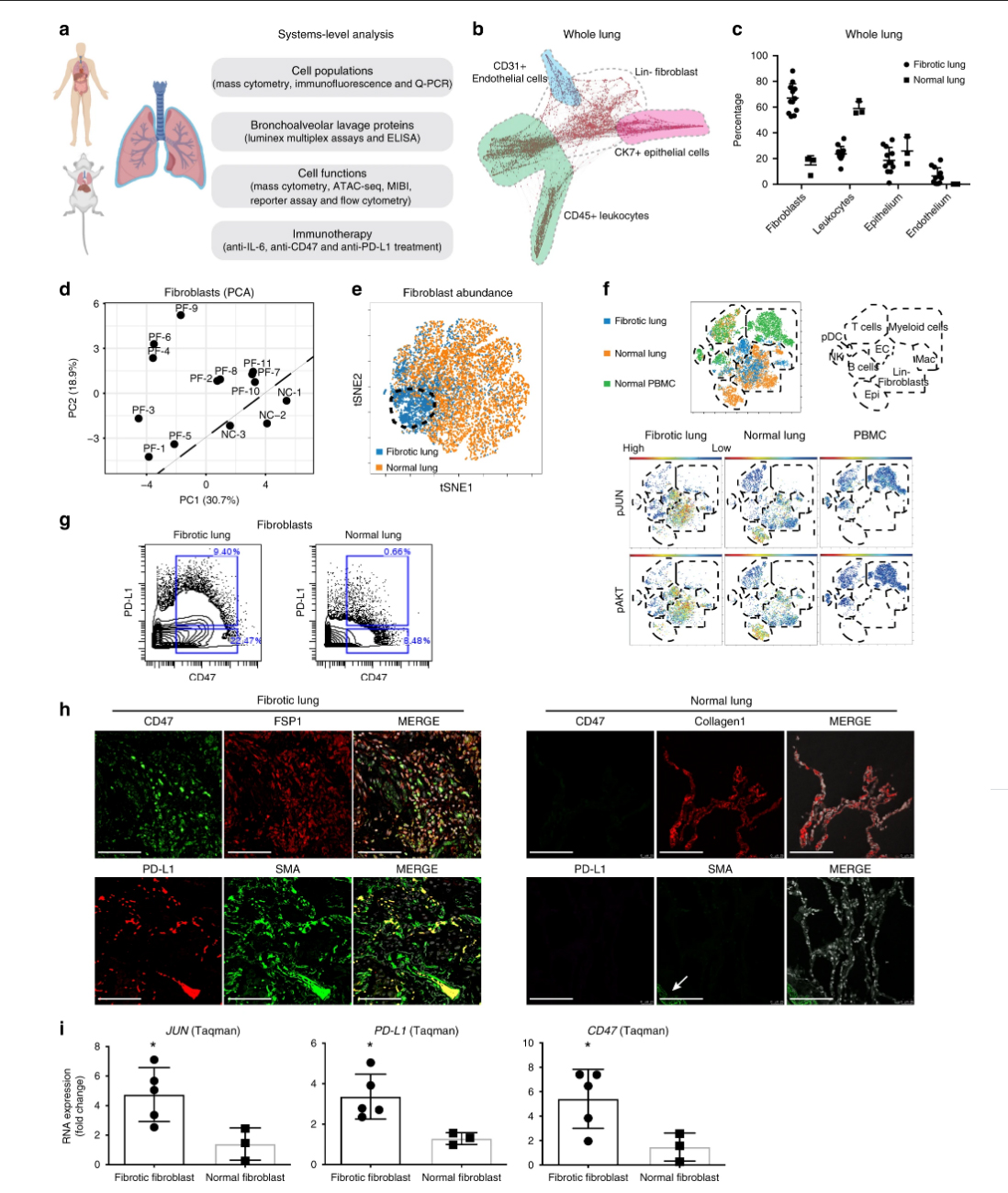
Fig. 1: Análisis a nivel de sistemas de pacientes con fibrosis pulmonar.
Un resumen de nuestro enfoque “Omics” en el pulmón fibrótico humano que integra plataformas de tecnología proteómica, secretómica y genómica para estudiar la contribución de los leucocitos y fibroblastos patológicos e identificar objetivos terapéuticos. b Diseño unicelular dirigido por la fuerza de los tejidos pulmonares fibróticos. Las regiones sombreadas indican la ubicación de las poblaciones celulares activadas manualmente. c Frecuencias de poblaciones celulares en el pulmón detectadas por citometría de masas (CyTOF). Los datos se muestran como media ± DE de 11 muestras fibróticas y 3 muestras normales de pulmón control. reLa PCA se calculó en grupos de fibroblastos de 11 pacientes con fibrosis pulmonar individual (PF) y 3 conjuntos de datos de citometría de masas de donantes normales (NC) que demuestran que los fibroblastos fibróticos y normales eran distintos entre sí. e Visne mapas de datos de citometría de masas de fibroblastos que demuestran que la abundancia de fibroblastos difería. Los datos demuestran un ejemplo representativo por grupo y cada punto en el mapa viSNE representa una celda individual. FEl análisis ViSNE de datos de citometría de masa de pulmón fibrótico, pulmón normal y PBMC normales reveló una mayor activación de las vías JUN y AKT en fibroblastos pulmonares fibróticos. El diagrama esquemático de la ubicación de los tipos de células indicados en el mapa viSNE se basa en la expresión de marcadores específicos de linaje. El rojo indica una expresión alta y azul baja en proteínas. g Gráficos representativos de citometría de masas de la población de fibroblastos pro-fibróticos en pulmón fibrótico en comparación con el pulmón normal. h Las manchas inmunes fluorescentes confirmaron un aumento de la coexpresión de CD47 y PD-L1 en fibroblastos de pulmón de pulmones fibróticos pero no en controles normales (fibroblastos activados que expresan FSP1 + Colágeno1 + y SMA +) La flecha indica el vaso sanguíneo. (Barras de escala, 100 μm). i El análisis de expresión de ARN de JUN , PD-L1 y CD47 en fibroblastos fibróticos y pulmonares normales se detectan mediante el ensayo Taqman. Los datos se expresan como media ± DE de 5 fibroblastos fibróticos y 3 fibroblastos normales y representativos de al menos tres experimentos. Los datos se analizaron mediante la prueba t no emparejada de dos colas , * P <0.05; ** P <0,01. Ver los datos complementarios 2 para detalles estadísticos. Los datos de origen se proporcionan como un archivo de datos de origen.
“Este estudio presenta la esperanza de una nueva opción de tratamiento que podría mejorar la condición de los pacientes con fibrosis pulmonar”, dijo Wernig. Actualmente, señala que el único remedio para la fibrosis pulmonar es un trasplante de pulmón.

Garry Nolan

Tristan Lerbs
Otros científicos de Stanford involucrados en la investigación fueron Garry Nolan , PhD, el profesor de patología Rachford y Carlota Harris; becarios posdoctorales Lu Cui, PhD, y Tristn Lerbs , MD; ex becarios posdoctorales Shih-Yu Chen, PhD, y Paola Betancur, PhD; ex estudiante de posgrado Sydney Gordon, PhD; y desarrollador de software Jin-Wook Lee, MS.
La investigación fue apoyada por el Instituto Nacional del Corazón, los Pulmones y la Sangre (subvención NHLBI 1222520-100-PAPGN); una beca de investigación en ciencias básicas por Boehringer-Ingelheim; y financiación de la Fundación de Investigación de Esclerodermia.
El Instituto Stanford de Biología de Células Madre y Medicina Regenerativa también apoyó el trabajo.