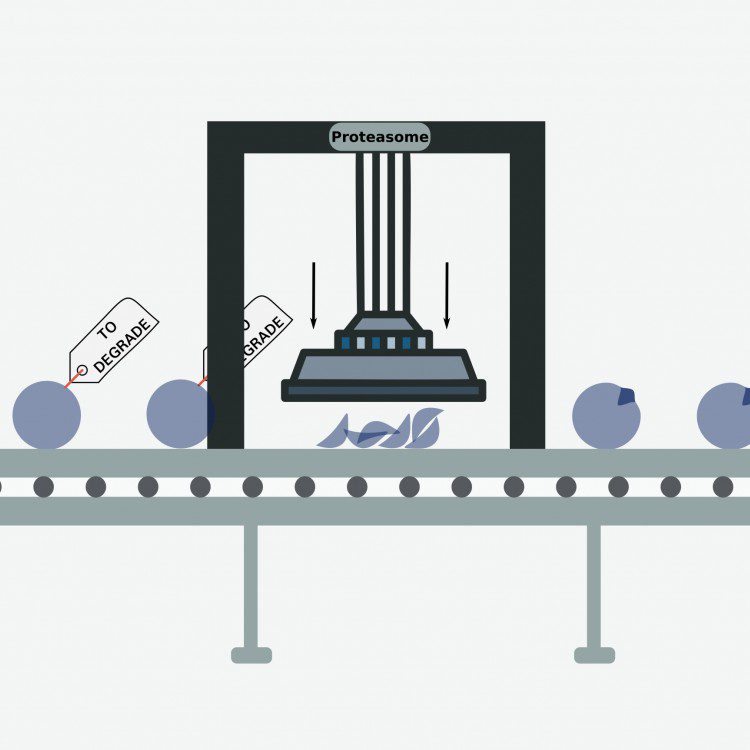
Para el estudio se ha desarrollado un modelo de inteligencia artificial que ha permitido obtener la más extensa anotación del sistema de degradación de proteínas mediado por ubiquitina.
El análisis propone una posible nueva vía de intervención clínica en cáncer a través de la inhibición de oncoproteínas con un comportamiento aberrante en su sistema de degradación.
Determinar qué alteraciones genéticas son las responsables de la aparición y evolución del cáncer, así como identificar los mecanismos mediante los cuáles las células sanas se transforman en malignas es esencial para entender las bases moleculares del cáncer.
Durante las últimas dos décadas, diversos estudios han identificado algunas alteraciones genéticas que interfieren con la degradación de proteínas y tienen un papel clave en la tumorigénesis. En las células tumorales que contienen este tipo de alteraciones se acumulan determinadas proteínas oncogénicas, dando lugar a un comportamiento celular aberrante. Sin embargo, aún no se conoce el alcance total de este mecanismo de desregulación de la degradación de las proteínas en la aparición del cáncer.

Abel David Gonzalez
Científicos del Instituto de Investigación Biomédica (IRB Barcelona) liderados por los investigadores Abel David González-Pérez y Núria López-Bigas, investigadora ICREA y jefa del Laboratorio de Genómica Biomédica y profesora asociada de la Universidad Pompeu Fabra,han publicado un estudio en la revista Nature Cancerque analiza cómo algunas alteraciones en el sistema de degradación de proteínas tienen un rol esencial en el proceso de generación de un tumor.

Nuria Lopez-Bigas
Para ello el equipo de investigadores identificó en cientos de proteínas las secuencias de degradación específicas, es decir, los fragmentos concretos de estas que son reconocidos y que promueven el marcaje con ubiquitina para su degradación. En esta primera fase se desarrolló un modelo de inteligencia artificial que permite identificar estas secuencias de reconocimiento en base a las propiedades bioquímicas aprendidas de las interacciones conocidas.
Para validar las secuencias de reconocimiento identificadas en estos cientos de proteínas se utilizaron como experimentos naturales, las mutaciones observadas en más de 7.000 tumores de pacientes y 900 líneas celulares de cáncer. Los autores demostraron que la mayoría de las mutaciones en las regiones de reconocimiento de las proteínas promueven su estabilización. Estos datos permitieron validar el modelo de predicción, determinando que una importante cantidad de las nuevas predicciones pueden ser funcionales. sistema de degradación de proteínas actúan en la generación de tumores
Como explica el codirector del estudio González-Pérez: “mediante nuestra investigación hemos identificado varios cientos de potenciales secuencias de reconocimiento de proteínas para su marcaje con ubiquitina, que constituyen candidatos fiables para su validación experimental”
Posteriormente, el equipo pasó a analizar las mutaciones genéticas presentes en estos más de 7.000 tumores de pacientes y 900 líneas celulares de cáncer para determinar cuáles de las secuencias de reconocimiento identificadas son explotadas por los tumores para evadir la degradación de proteínas oncogénicas. Asistema de degradación de proteínas actúan en la generación de tumores
El estudio concluye que un número importante de las mutaciones que causan los tumores (aproximadamente una de cada diez) suceden en oncoproteínas que explotan este mecanismo para evadir su degradación, incluyendo algunas no reportadas hasta la fecha.
Por ello, los investigadores proponen una posible nueva vía de intervención clínica en cáncer a través de la inhibición de oncoproteínas con un comportamiento aberrante en su sistema de degradación.

Francisco Martinez
“La idea consiste en inhibir de modo específico una oncoproteína cuyo nivel en la célula es excesivo debido al fallo en su mecanismo de degradación mediado por ubiquitina. Este paradigma permitiría ampliar el espectro de pacientes que podrían beneficiarse de las terapias que actualmente están aprobadas para su uso clínico, o que se encuentran en ensayos clínicos”, explica Francisco Martínez-Jiménez, investigador del IRB Barcelona y primer autor del estudio.
Este estudio ha sido posible gracias a la generosidad de los pacientes que compartieron sus muestras para investigación. Los autores también agradecen el trabajo tanto del personal médico que obtuvo las muestras, como de todos los investigadores involucrados en el proyecto de TCGA y CCLE por compartir públicamente los datos de mutaciones, expresión de mRNA y de expresión de proteínas. “Este estudio es un ejemplo de cómo compartir datos puede mejorar el progreso científico” comenta González-Pérez.
La investigación ha contado con financiación del Consejo Europeo de Investigación (ERC, por sus siglas en inglés) y del Ministerio de Ciencia, Innovación y Universidades de España.
Artículo de referencia:
Francisco Martínez-Jiménez , Ferran Muiños, Erika López-Arribillaga, Nuria Lopez-Bigas and Abel Gonzalez-Perez
Systematic analysis of alterations in the ubiquitin proteolysis system reveals its contribution to driver mutations in cancer
Nature Cancer (2019) DOI: 10.1038/s43018-019-0001-2
Identificadas alteraciones genéticas causadas por terapias contra el cáncer
Los daños que causa la “quimio” en el ADN
Nos hacemos eco de la publicación en Nature Genetics del trabajo de investigación llevado a cabo en el Laboratorio de Genómica Biomédica, dirigido por Núria López Bigas, por el cual se han determinado por primera vez las alteraciones genéticas causadas por varias terapias utilizadas en el tratamiento del cáncer. “Estudiar las mutaciones producidas por las quimioterapias en el ADN de las células de los pacientes es un primer paso para comprender la relación de dichas mutaciones con los efectos secundarios de estas terapias a largo plazo”, señala Oriol Pich, estudiante predoctoral del IRB Barcelona y primer autor del artículo.
Los científicos del IRB Barcelona determinan las alteraciones genéticas en las células de los pacientes con cáncer causadas por las principales terapias contra el cáncer.
Este es un paso importante para comprender los efectos secundarios a largo plazo y optimizar los tratamientos contra el cáncer.
Los resultados han sido publicados en la revista Nature Genetics.
Vivir implica cambio. Esto es lo que les sucede a las células de nuestros cuerpos a medida que envejecemos: acumulan alteraciones genéticas, la mayoría de las cuales son inofensivas. Sin embargo, en algunos casos específicos, estas mutaciones pueden afectar ciertos genes y pueden conducir al desarrollo de cáncer. La fuente de estas alteraciones puede ser exógena (p. Ej., Radiación solar, humo de tabaco o alguna sustancia tóxica) o endógena (p. Ej., Errores en el procesamiento del ADN).

Nuria López-Bigas
Científicos dirigidos por la investigadora ICREA Núria López-Bigas , directora del Laboratorio de Genómica Biomédica del Instituto de Investigación en Biomedicina (IRB Barcelona) y Profesora Asistente de la Universidad Pompeu Fabra, han caracterizado por primera vez las alteraciones genéticas causadas por seis terapias ampliamente. utilizado para el tratamiento del cáncer (cinco basados en medicamentos utilizados como quimioterapias y radioterapia). Los resultados han sido publicados hoy en la revista Nature Genetics .
Las quimioterapias han revolucionado el tratamiento del cáncer, permitiendo la supervivencia de un gran número de pacientes. Algunas de estas terapias matan las células cancerosas al dañar su ADN. Sin embargo, estos medicamentos también pueden dañar las células sanas del paciente, lo que explica sus efectos secundarios.

Oriol Pich
“Es importante recordar que las quimioterapias son altamente eficientes para el tratamiento del cáncer”, dice Oriol Pich , estudiante de doctorado en el IRB Barcelona y primer autor del estudio. “Pero también se han informado efectos secundarios a largo plazo en algunos pacientes. Estudiar las mutaciones de ADN que se producen en las células como resultado de las quimioterapias es el primer paso para comprender la relación entre estas mutaciones y los efectos secundarios a largo plazo de estos tratamientos “.sistema de degradación de proteínas actúan en la generación de tumores
Para llevar a cabo el estudio, la Hartwig Medical Foundation en los Países Bajos proporcionó a los científicos las secuencias de los tumores metastásicos de alrededor de 3.500 pacientes e información sobre los tratamientos que recibieron. Utilizando técnicas de bioinformática, el grupo de López-Bigas ha podido identificar un patrón específico de mutaciones en los tumores metastásicos de los pacientes para cada una de las terapias más utilizadas: su “huella mutacional”.
“Una vez que se ha identificado esta” huella “, podemos cuantificar las mutaciones de ADN que han sido causadas por cada tipo de quimioterapia, así como las causadas por las combinaciones de tratamiento”, explica López-Bigas . “Hemos comparado estos números con las alteraciones genéticas causadas por procesos endógenos naturales. Hemos calculado que, durante el tratamiento, algunas de estas quimioterapias causan mutaciones en el ADN a un ritmo que es entre 100 y 1000 veces más rápido que lo que normalmente ocurre en una célula “.
Este conocimiento permitirá la optimización de los tratamientos contra el cáncer. “El objetivo es maximizar los efectos beneficiosos de las quimioterapias mediante la destrucción de las células tumorales y minimizar el número de mutaciones causadas en las células sanas de los pacientes. Esto se lograría a través de una cuidadosa combinación de dosis y duración del tratamiento ”, dice López-Bigas .
Esta investigación ha sido posible gracias a los pacientes y sus familias que permitieron que las muestras tomadas se utilizaran con fines de investigación científica. El estudio fue financiado por el Consejo Europeo de Investigación (ERC), el Ministerio de Ciencia, Innovación y Universidades del Gobierno español y el Ministerio de Empresa y Conocimiento del Gobierno catalán. Oriol Pich ha recibido una beca del Instituto de Ciencia y Tecnología de Barcelona (BIST).
Artículo de referencia:
Oriol Pich, Ferran Muiños, Martijn Paul Lolkema, Neeltje Steeghs, Abel Gonzalez-Perez y Nuria Lopez-Bigas
IRB Barcelona- Diana terapéutica para la enfermedad de Kennedy y el cáncer de próstata
IRB, Pacientes de cáncer pueden beneficiarse de la inmunoterapia



