Los químicos vislumbran el fugaz “estado de transición” de una reacción.
La nueva técnica para observar los productos de reacción ofrece información sobre los mecanismos químicos que los formaron.
Anne Trafton | MIT News Office
16 de diciembre de 2019
Durante una reacción química, las moléculas involucradas en la reacción ganan energía hasta que alcanzan un “punto de no retorno” conocido como estado de transición.
Hasta ahora, nadie ha vislumbrado este estado, ya que dura solo unos pocos femtosegundos (cuadrillonésimos de segundo). Sin embargo, los químicos del MIT, el Laboratorio Nacional de Argonne y varias otras instituciones han ideado una técnica que les permite determinar la estructura del estado de transición mediante la observación detallada de los productos que resultan de la reacción.
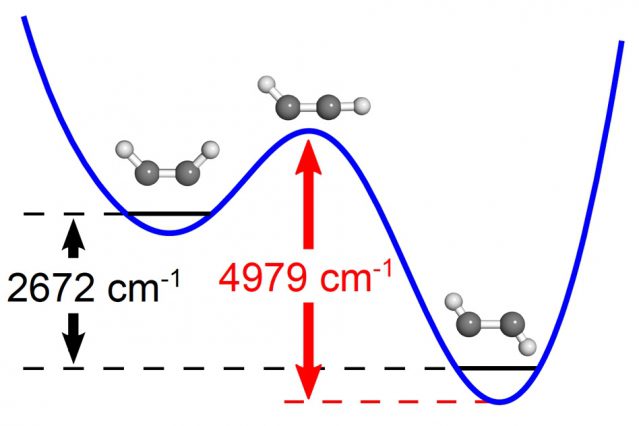
Los químicos del MIT calcularon la energía requerida para que una molécula de acetileno en la conformación en forma de U alcance el estado de transición. Una vez que se alcanza ese estado, la reacción se completa y el acetileno adquiere una conformación en zig-zag.
Cortesía de los investigadores.
“Estamos observando las consecuencias del evento, que han codificado en ellas la estructura real del estado de transición”, dice Robert Field, Robert T. Haslam y Bradley Dewey Profesor de Química en el MIT. “Es una medición indirecta, pero se encuentra entre las clases de medición más directas que han sido posibles”.

Robert W Field
Field y sus colegas utilizaron la espectroscopía de ondas milimétricas, que puede medir la energía rotacional-vibracional de las moléculas de los productos de reacción, para determinar la estructura de los productos de la descomposición del cianuro de vinilo causado por la luz ultravioleta. Usando este enfoque, identificaron dos estados de transición diferentes para la reacción y encontraron evidencia de que podrían estar involucrados estados de transición adicionales.
Field es el autor principal del estudio, que aparece esta semana en las Actas de la Academia Nacional de Ciencias . El autor principal es Kirill Prozument, un ex postdoc del MIT que ahora está en el Laboratorio Nacional de Argonne.

Kirill Prozument
Un concepto central de la química.
Para que ocurra cualquier reacción química, las moléculas que reaccionan deben recibir un aporte de energía que permita a las moléculas activadas alcanzar un estado de transición, a partir del cual se forman los productos.
“El estado de transición es un concepto central de la química”, dice Field. “Todo lo que pensamos en las reacciones depende realmente de la estructura del estado de transición, que no podemos observar directamente”.
En un artículo publicado en 2015, Field y sus colegas utilizaron la espectroscopía láser para caracterizar el estado de transición para un tipo diferente de reacción conocida como isomerización, en la que una molécula experimenta un cambio de forma.
En su nuevo estudio, los investigadores exploraron otro estilo de reacción, utilizando radiación láser ultravioleta para romper moléculas de cianuro de vinilo en acetileno y otros productos. Luego, utilizaron la espectroscopía de ondas milimétricas para observar la distribución de la población del nivel vibratorio de los productos de reacción unas pocas millonésimas de segundo después de que ocurriera la reacción.
Usando esta técnica, los investigadores pudieron determinar poblaciones nacientes de moléculas en diferentes niveles de energía vibracional, una medida de cuánto se mueven los átomos de una molécula entre sí. Esos niveles de energía vibracional también codifican la geometría de las moléculas cuando nacieron en el estado de transición, específicamente, cuánta excitación de flexión hay en los ángulos de enlace entre los átomos de hidrógeno, carbono y nitrógeno. vislumbran el fugaz “estado de transición” de una reacción
Esto también permitió a los investigadores distinguir entre dos productos ligeramente diferentes de la reacción: el cianuro de hidrógeno (HCN), en el que un átomo de carbono central está unido a hidrógeno y nitrógeno, y el isocianuro de hidrógeno (HNC), en el que el nitrógeno es el átomo central, unido a carbono e hidrógeno.
“Esta es la huella digital de lo que era la estructura durante el instante en que se liberó la molécula”, dice Field. “Los métodos anteriores de observar las reacciones eran ciegos a las poblaciones vibratorias, y eran ciegos a la diferencia entre HCN y HNC”.

Túnel cuántico espeluznante observado por los químicos
Los investigadores encontraron HCN y HNC, que se producen a través de diferentes estados de transición, entre los productos de reacción. Esto sugiere que ambos estados de transición, que representan diferentes mecanismos de reacción, están en juego cuando el láser ultravioleta rompe el cianuro de vinilo.
“Esto implica que hay dos mecanismos diferentes que compiten por los estados de transición, y podemos separar la reacción en estos mecanismos diferentes”, dice Field. “Esta es una técnica completamente nueva, una nueva forma de llegar al corazón de lo que sucede en una reacción química”.
La nueva técnica permite a los científicos explorar el estado de transición de una manera que anteriormente no había sido posible, dice Arthur Suits, profesor de química en la Universidad de Missouri.
“En este trabajo, los investigadores utilizan la nueva y poderosa técnica de espectroscopía rotacional de banda ancha para monitorear las distribuciones vibratorias nacientes de los productos de una reacción de fotodisociación, obteniendo así una visión profunda de dos estados de transición diferentes”, dice Suits, que no participó en el estudiar. “La espectroscopía rotacional de banda ancha continúa asombrándonos con aplicaciones inesperadas como esta visión de la difícil transición, y otros avances emocionantes impulsados por esta técnica están sin duda en camino”.
Mecanismos adicionales vislumbran el fugaz “estado de transición” de una reacción
Los datos de los investigadores muestran que existen mecanismos de reacción adicionales más allá de esos dos, pero se necesitan más estudios para determinar sus estructuras de estado de transición.
Field y Prozument ahora están utilizando esta técnica para estudiar los productos de reacción de la descomposición pirolítica de la acetona. También esperan usarlo para explorar cómo la triazina, un anillo de seis miembros de átomos alternos de carbono y nitrógeno, se descompone en tres moléculas de HCN, en particular, si los tres productos se forman simultáneamente (un “triple golpe”) o secuencialmente.
La investigación fue financiada por el Departamento de Energía, el Fondo de Investigación del Petróleo y la Fundación Nacional de Ciencia. Otros autores del artículo incluyen Joshua Baraban PhD ’13 de la Universidad Ben-Gurion; G. Barratt Park PhD ’15 del Instituto Max Planck de Química Biofísica; Rachel Shaver SM ’13; P. Bryan Changala de la Universidad de Colorado en Boulder; John Muenter de la Universidad de Rochester; Stephen Klippenstein del Laboratorio Nacional de Argonne; y Vladimir Chernyak de la Universidad Estatal de Wayne.
Texto original Ingles: https://mailchi.mp/9bde9f60a464/chemists-glimpse-a-transition-state-natural-gas-uncertain-role-infinite-magazine


