HSCI, investigación de la distrofia muscular |
La colaboración de distrofia muscular tiene como objetivo corregir el ADN de las células madre musculares
La investigación de HSCI recibe el apoyo de Sarepta para avanzar en la edición in vivo del genoma hacia la terapia prospectiva.
Con el apoyo de la financiación sustancial de Sarepta Therapeutics, los investigadores de HSCI dirigidos por Amy Wagers se embarcan en un importante estudio de la (DMD).
- El problema: DMD es una enfermedad genética causada por la falta de la proteína distrofina. Sin distrofina, las fibras musculares degeneran más rápido y los pacientes pierden la capacidad de moverse de forma independiente.
- El objetivo: Los investigadores tienen como objetivo corregir el gen de la distrofina en modelos animales de DMD, apuntando al ADN de las células madre que regeneran las células musculares. Los investigadores evitarán perturbar las células madre editando el gen directamente en los sistemas vivos, en lugar de en un plato de laboratorio.
- Por qué importa: Este enfoque de edición de genes puede señalar el camino a una estrategia terapéutica eventual para revertir la DMD en humanos.

Amy Wagers, PhD, Copresidente, Investigador principal del Departamento de Harvard de células madre y biología regenerativa
, Islet Cell and Regenerative Biology, Joslin Diabetes Center
Investigadores de HSCI dirigidos por Amy Wagers, Ph.D. se están embarcando en un importante estudio de distrofia muscular de Duchenne (DMD). El proyecto tiene como objetivo utilizar la edición in vivo del genoma en modelos de DMD en ratones para restaurar total y precisamente la función de la proteína distrofina, que es crucial para el crecimiento y desarrollo muscular adecuados. Los enfoques validados por este trabajo pueden indicar el camino hacia una eventual estrategia terapéutica para revertir la DMD en humanos.
El proyecto está respaldado por fondos de investigación de Sarepta Therapeutics, bajo un acuerdo de colaboración de varios años coordinado por la Oficina de Desarrollo Tecnológico de Harvard (OTD).
Una enfermedad genética devastadora HSCI, investigación de la distrofia muscular
La distrofia muscular de Duchenne es una enfermedad genética causada por la falta de una proteína llamada distrofina que normalmente ayuda a mantener la integridad estructural de las fibras musculares, incluidas las del corazón. Sin la proteína distrofina, las células son más débiles y se degeneran más rápidamente. Con el tiempo, las personas afectadas, típicamente niños, ya que es un trastorno recesivo ligado al cromosoma X, pierden su capacidad de moverse de forma independiente.
“Es realmente una enfermedad devastadora; les roba a los niños pequeños su capacidad de ser niños pequeños “, dijo Wagers, quien es el profesor de la familia Forst de células madre y biología regenerativa, copresidente del Departamento de Harvard de células madre y biología regenerativa y miembro del Comité Ejecutivo de HSCI . “Aunque es temprano, espero que a través de este trabajo podamos identificar y validar nuevas vías de terapia para rescatar por completo la expresión y función adecuadas de la proteína distrofina y regenerar el tejido muscular sano”.
Los investigadores de todo el mundo han seguido una variedad de enfoques prometedores, como terapias celulares y genéticas, terapias de moléculas pequeñas y otros, para disminuir o prevenir la enfermedad y mejorar la calidad de vida de los pacientes.
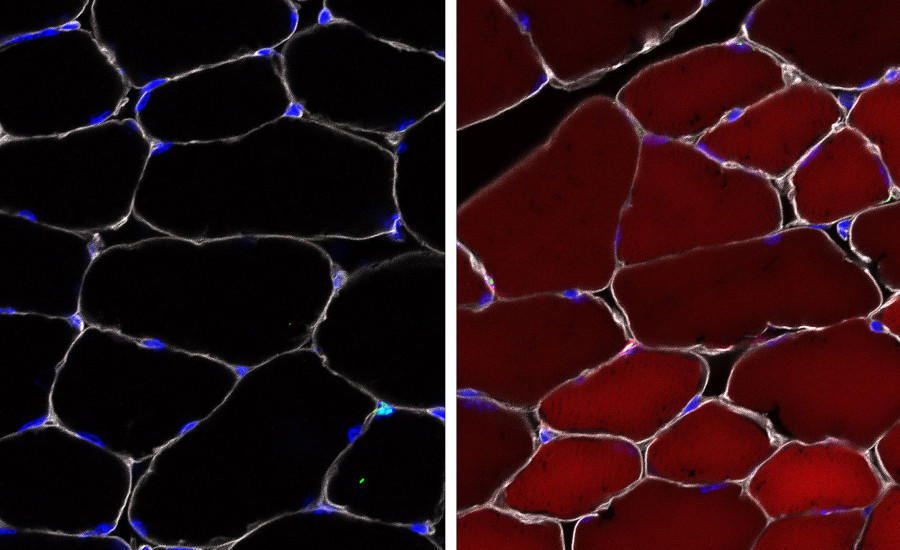
Imágenes de fluorescencia que muestran células “informadoras” que se vuelven rojas cuando se activan, lo que indica que el virus adenoasociado utilizado como vehículo de transporte ha dado en el blanco. La izquierda muestra las celdas preinyectadas, mientras que la derecha muestra el resultado después de que se hayan inyectado las celdas. Foto del laboratorio Bryan Peacker / Wagers de la Universidad de Harvard.
Corrección de ADN en la fuente
La estrategia seguida por el Laboratorio Wagers tiene como objetivo corregir completamente la plantilla genética de la distrofina en su origen, en el ADN de las células madre (células satélite) que crean y regeneran las células musculares. Combinando tecnologías de edición de genoma CRISPR / Cas9 de vanguardia con un profundo conocimiento de la ciencia de las células madre y la biología regenerativa, este enfoque, si tiene éxito, podría ofrecer una restauración permanente de la función muscular.
“En el músculo esquelético, las fibras musculares son terminalmente post-mitóticas, lo que significa que no pueden dividirse y no pueden reproducirse”, explica Wagers. “Si pierde fibras musculares, la única forma de producir músculo nuevo es a partir de células madre, específicamente las células satélite. Las células satélite se renuevan por sí mismas, se reparan por sí mismas y están listas para entrar en acción para crear nuevas fibras musculares. Por lo tanto, esperamos que una célula satélite con el gen DMD corregido propague de manera bastante rápida y continua el gen editado por todo el tejido muscular “.
En la actualidad, la investigación realizada en ratones ha mostrado resultados prometedores. En 2019, el Laboratorio Wagers publicó los resultados de la edición de células madre in vivo , demostrando que los genes de células madre pueden editarse en sistemas vivos, no solo en un plato. En ese trabajo, Wagers y su equipo entregaron moléculas de edición del genoma a las células utilizando virus adenoasociados (AAV). Su laboratorio también ha utilizado con éxito la edición de genes en el corazón, los músculos y las células satélite para restaurar parcialmente la función del gen DMD que codifica la distrofina, cortando secuencias de código defectuosas que están interrumpiendo el marco de lectura adecuado.
Una nueva colaboracion HSCI, investigación de la distrofia muscular
El nuevo enfoque de células madre aplicado en colaboración con Sarepta se basaría en estos logros y utilizaría enfoques de edición del genoma más precisos, en modelos animales de DMD, para reemplazar por completo las mutaciones genéticas en el gen DMD con secuencias codificadas correctamente. El proyecto también explorará métodos y estrategias de entrega alternativos para mitigar los efectos inmunes de la edición del genoma in vivo .
“Este ambicioso proyecto se beneficiará en gran medida de los recursos y las ideas de una empresa con una profunda experiencia clínica en el desarrollo de terapias para la distrofia muscular”, dijo Vivian Berlin, Directora Gerente de Alianzas Estratégicas en Harvard OTD. “Los descubrimientos preclínicos realizados por investigadores de Harvard pueden abrir posibilidades completamente nuevas para tratamientos que salvan vidas a largo plazo, ofreciendo una esperanza muy necesaria para los pacientes y sus familias en el futuro. Estamos agradecidos de poder mantener el importante impulso ya establecido en el laboratorio del Prof. Wagers, a través de esta colaboración ”.
“A medida que trabajamos para presentar nuevos tratamientos para pacientes con DMD, Sarepta se complace en apoyar a la profesora Wagers y su laboratorio para acelerar el desarrollo de un enfoque de edición de genes, que ha demostrado un potencial significativo en los primeros estudios”, dijo Louise Rodino-Klapac , Vicepresidente sénior de terapia génica de Sarepta. “Esta colaboración de varios años es parte del compromiso más amplio de Sarepta de buscar todas las modalidades terapéuticas y avanzar en nuestra comprensión científica de la edición de genes para maximizar el potencial de este enfoque para ayudar a los pacientes”.
Lee mas
Esta historia fue publicada originalmente en el sitio web de OTD el 13 de enero de 2020.
Noticias relacionadas con HSCI: Edición de genes en la fuente



