Algo esta cambiando ,Dos mujeres ganan por primera vez el Nobel de Física y el Nobel de Química en el mismo año
Fuente :PÚBLICO | EFE
NOBEL DE FÍSICA , La canadiense Strickland, primera mujer en recibir el Nobel de Física en 55 años
La Real Academia de las Ciencias de Suecia reconoce los avances en tecnología de la física láser. La mitad del premio ha recaído en el estadounidense Arthur Ashkin por sus “pinzas ópticas”, mientras que Strickland y su colega francés Gerard Mourou comparten la otra mitad por su método para generar impulsos ópticos ultra cortos y de alta intensidad
Han tenido que pasar 55 años para que un nombre femenino aparezca en los Premios Nobel de Física. La canadiense Donna Strickland se ha convertido en la tercera mujer que pasa a la historia de los galardones más distinguidos en el campo de las ciencias, junto a Marie Curie y Maria Goeppert-Mayer.
De izquierda a derecha, Marie Curie, Maria Goeppert-Mayer y Donna Strickland. / ARCHIVO FUNDACIÓN NOBEL – REUTERSLa Real Academia de las Ciencias de Suecia ha comunicado este martes que el Nobel de Física se reparte entre tres científicos que han desarrollado “invenciones innovadoras en el campo de la física láser” que permiten aplicar esa tecnología en la medicina y otras áreas.

Donna-Strickland
©University of Waterloo
Strickland, nacida en Guelph en 1959, estudió primero ingeniería y luego se doctoró en 1989 en física en la Universidad de Rochester, donde su colega Mourou fue profesor. Ambos impulsaro el CPA en 1985 y, según la academia, las áreas de aplicación que tiene esta tecnología no han sido todavía completamente exploradas. En la actualidad, Strickland es profesora asociada en la Universidad de Waterloo, en Otario.
Por cierto, quizás Donna Strickland es el primer profesor de universidad en recibir un Premio Nobel de Física que no es catedrático de universidad (full professor), solo es profesora titular (associate professor) a sus 59 años; según la Universidad de Waterloo nunca solicitó una plaza de catedrático. Supongo que pronto se le concederá, … aunque no la pida (al menos a título honorífico)

La mitad del galardón ha recaído en estadounidense Arthur Ashkin y sus “pinzas ópticas y su aplicación en sistemas biológicos”, mientras que la otra mitad del premio lo comparten la mencionada Strickland y el francés Gerard Mourou por “su método para generar impulsos ópticos ultra cortos y de alta intensidad”, que han “abierto nuevas áreas de investigación y llevado a muchas aplicaciones industriales y médicas”.
Base para la cirugía ocular por láser
Gérard Mourou y Donna Strickland han allanado el camino hacia los pulsos de láser más cortos e intensos creados por la humanidad. Su artículo revolucionario fue publicado en 1985 y fue la base de la tesis doctoral de Strickland.
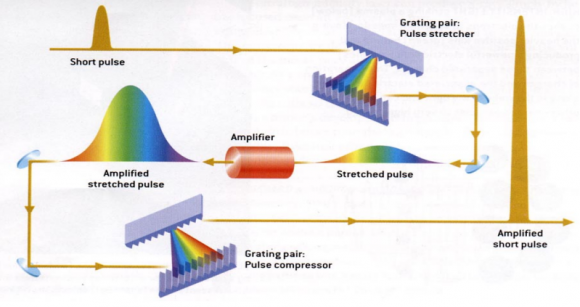
Utilizando un enfoque ingenioso, lograron crear pulsos de láser de alta intensidad ultracortos sin destruir el material amplificador. Primero estiraron los pulsos de láser en el tiempo para reducir su potencia máxima, luego los amplificaron y finalmente los comprimieron. Si un pulso es comprimido en el tiempo y se hace más corto, puede reunirse más luz en el mismo pequeño espacio, con lo que la intensidad del pulso aumenta drásticamente.
La nueva técnica de Strickland y Mourou, llamado CPA (Chirped Pulse Amplification) pronto se convirtió en estándar para los posteriores láseres de alta intensidad. Sus usos incluyen los millones de cirugías oculares correctivas que se realizan cada año usando los rayos láser más nítidos.
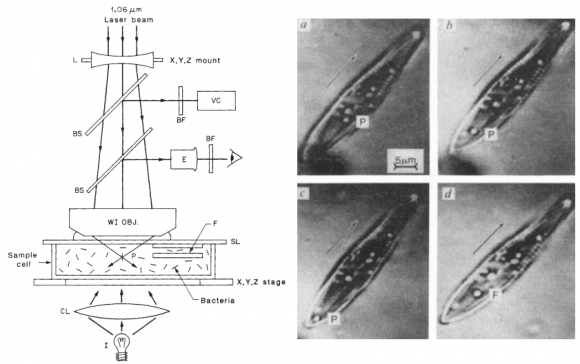
Ashkin nació en 1922 en Nueva York y se doctoró en la estadounidense Universidad de Cornell tras sus estudios en el Columbia College. Es el mayor de los tres galardonados y trabajó en los Laboratorios Bell hasta que creó su propio laboratorio. Junto con su colega Steven Chu, que recibió el Premio Nobel en 1997, desarrolló la llamada “pinza óptica” con la que mostró en 1967 como se podían mover, con láser, bolas microscópicas de láser. Posteriormente, Ashkin empezó a utilizar la “pinza óptica” en objetos biológicos, de forma que hizo posible la manipulación de organismos microscópicos como virus y bacterias.
Según la Real Academia Sueca de las Ciencias en la actualidad se usa la pinza óptica en muchos laboratorios para estudiar procesos biológicos como la actividad de las proteínas, el ADN o la vida interior de las células.
Arthur Ashkin propuso en 1970 que la presión de radiación permite atrapar y manipular micropartículas (A. Ashkin, “Acceleration and Trapping of Particles by Radiation Pressure,” Phys. Rev. Lett. 24: 156 (1970), doi: 10.1103/PhysRevLett.24.156). Pero el concepto moderno de pinzas ópticas se propuso en 1986 para usar la luz láser para atrapar partículas, moléculas y átomos. Su aplicación más relevante ha sido en biología, donde se usan para atrapar virus, bacterias y células vivas. En células eucariotas no solo se puede manipular la célula completa, sino también sus orgánulos. Ashkin lleva estudiando el láser en los Laboratorios Bell desde principios de los 1960. La idea de las pinzas ópticas se inspira en el rayo tractor de Star Trek. El artículo pionero es A. Ashkin, J. M. Dziedzic, …, Steven Chu, “Observation of a single-beam gradient force optical trap for dielectric particles,” Optics Letters 11: 288-290 (1986), doi: 10.1364/OL.11.000288.
Enfocar los láseres mediante lentes y aprovechar la presión de radiación para atrapar y manipular partículas que flotan en un fluido no parece un gran logro científico. El galardón de la Academia Sueca ha destacado el mayor éxito de Ashkin, la publicación en Nature y Science de un sistema de manipulación de células vivas usando pinzas ópticas. Los artículos son A. Ashkin, J. M. Dziedzic, T. Yamane, “Optical trapping and manipulation of single cells using infrared laser beams,” Nature 330: 769–771 (31 Dec 1987), doi: 10.1038/330769a0, y A. Ashkin, J. M. Dziedzic, “Optical trapping and manipulation of viruses and bacteria,” Science 235: 1517-1520 (20 Mar 1987), doi: 10.1126/science.3547653.
Algo que parecía ciencia ficción es hoy realidad en muchos laboratorios del mundo. Gracias a las pinzas ópticas se ha podido estudiar cómo funcionan los motores moleculares en las células, cómo se mueven las proteínas por la superficie de un orgánulo celular, o incluso separar células sanas de células infectadas en un tejido. La capacidad actual de manipulación de objetos mediante pinzas ópticas es realmente asombrosa.
Gérard Mourou,
nació en Albertville (Francia) en 1944 y se doctoró en la Universidad de París en Orsay. Trabajó en varias universidades estadounidenses, entre ellas la Universidad de Michigan, y actualmente es director del Laboratorio de Óptica Aplicada de la Escuela Politécnica de París y del Centro Nacional de Investigaciones Científicas.
El Nobel lo recibió por ser uno de los inventores del llamado CPA, para generar breves impulsos láser de gran intensidad, un avance que desarrolló junto a la canadiense Donna Strickland.
Gérard Mourou y Donna Strickland desarrollaron en 1985 una técnica para la compresión y amplificación de pulsos ópticos capaz de producir pulsos de picosegundos con energías del orden del milijulio. Esta técnica, llamada CPA (chirped pulse amplification), no destruía el material que actúa como amplificador de la señal láser, como técnicas anteriores. La técnica CPA fue desarrollada en la tesis doctoral de Strickland; ella ha recibido el galardón junto a su director de tesis, a diferencia del caso de Jocelyn Bell, en el que solo lo recibió el director de la tesis, Antony Hewish. El artículo es Donna Strickland, Gerard Mourou, “Compression of amplified chirped optical pulses,” Optics Communications 55: 447-449 (15 Oct 1985), doi: 10.1016/0030-4018(85)90151-8.
Las tres etapas de la generación de pulsos mediante la técnica CPA son: (1) un pulso láser ultracorto se comprime en tiempo (luego su espectro se ensancha) reduciendo su potencia pico; (2) se amplifica el pulso en un material adecuado; y (3) se comprime de nuevo el pulso a su duración en tiempo inicial, manteniendo la potencia. En el artículo original de 1985 se partía de un pulso láser Nd:YAG de un nanojulio que se introducía en una fibra óptica monomodo para comprimirlo a una duración de trescientos picosegundos (millonésimas de segundo). Usando una pareja de rejillas (grating pair) se producía el ensanchamiento en frecuencia (chirping). Luego se introducía en un amplificador regenerativo de Nd:vidrio que amplificaba el pulso a un milijulio. Finalmente, una segunda pareja de rejillas volvía a comprimir en tiempo el pulso a solo dos picosegundos.
En muy poco tiempo tras el desarrollo de la técnica CPA se logró generar pulsos de picosegundos con potencias de un teravatio. La técnica CPA es la que se usa en la actualidad para genera pulsos ultracortos de alta intensidad (potencias hasta el nivel del petavatio) en la escala de los femtosegundos (milbillonésimas de segundo); con menor intensidad se producen pulsos de attosegundos (trillonésimas de segundo), millones de veces más cortos que los del artículo original. Como son pulsos de alta intensidad se usan en gran número de aplicaciones en ciencia de los materiales, química (como el Premio Nobel de Química 1999 a Ahmed Zewail), biología y hasta medicina. El futuro de esta tecnología óptica es alcanzar intensidades aún mayores, potencias de hasta cien petavatios o quizás incluso en la escala de los exavatios, reduciendo las duraciones desde attosegundos a los zeptosegundos.
Fuente: https://francis.naukas.com/
https://francis.naukas.com/2018/10/02/premio-nobel-de-fisica-2018-arthur-ashkin-pulsos-laser-ultracortos-y-gerard-mourou-y-donna-strickland-pinzas-opticas-en-biologia/
Una anécdota curiosa,
Mourou realizó este vídeo con un grupo de alumnos en 2009 para promocionar los láseres de precisión, Extreme Light Infrastructure (ELI)
El Nobel de Física 2018, el francés Gérard Mourou, ha sido estos días objeto de manipuladoras críticas, tras la viralización de un vídeo de 2009 en el que el científico aparece bailando con un grupo de estudiantes.
Alabamos su buen humor de un genio.
Los premios son entregados el 10 de diciembre, coincidiendo con el aniversario de la muerte de su fundador, Alfred Nobel, en una doble ceremonia en el
NOBEL DE QUÍMICA 2018
La Academia Sueca de Ciencias concedió este miércoles el Nobel de Química 2018 a la científica estadounidens del Instituto de Tecnología de Californiae
Frances H. Arnold, que se ha convertido en la quinta mujer en ganar este premio.
El Nobel de Química se reparte este año en una mitad para Arnold y la otra mitad compartida para el estadounidense George Smith y el británico Gregory P. Winter por “la evolución dirigida de enzimas”, según ha informado este miércoles la Real Academia de las Ciencias de Suecia.
“Los ganadores del premio de este año han dominado la evolución y usado los mismos principios -cambios genéticos y selección- para desarrollar proteínas que resuelven los problemas químicos de la humanidad“, según la información proporcionada por el comité nobel.
Los métodos creados por los galardonados “se desarrollan ahora internacionalmente para promover una industria química más verde, producir nuevos materiales, producir biocombustibles sostenibles, mitigar enfermedades y salvar vidas”.
Arnold, doctorada en Ingeniería Química en la Universidad estadounidense de Berkeley, llevó a cabo la primera evolución dirigida de enzimas, que son las proteínas que catalizan las reacciones químicas en los seres vivos, que han servido para producir desde biocombustibles a medicinas.
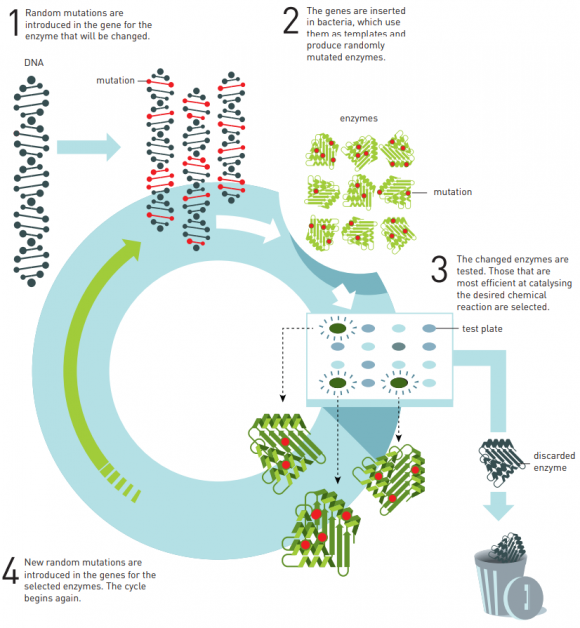
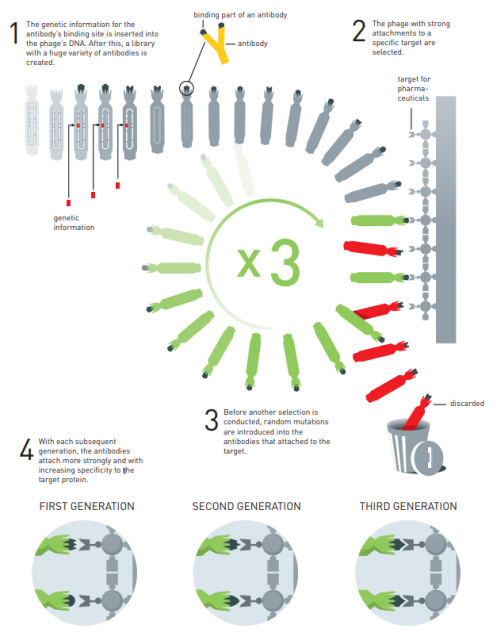
La Dra. Arnold desarrolló en 1993 los primeros estudios de evolución dirigida de enzimas (proteínas que catalizan reacciones químicas). Estos métodos permiten fabricar proteínas con un método respetuoso con el medio ambiente, tanto para la industria farmacéutica como para la producción biocombustibles renovables. El Dr. Smith desarrolló en 1985 el método de presentación de bacteriófagos (virus que infectan bacterias) para fabricar nuevas proteínas (que se presentan en su superficie). El Dr. Winter usó este método para la fabricación de anticuerpos, con el objetivo de desarrollar nuevos fármacos. El primer fármaco comercial fabricado con este método es adalimumab, aprobado en 2002 para tratar la artritis reumatoide, psoriasis e inflamaciones del intestino. Hoy en día hay muchos otros fármacos fabricados con estos métodos que se usan para tratar enfermedades tan extendidas como diferentes tipos de cáncer.
El anuncio oficial del premio está en Press Release, la información divulgativa en Popular Science Background, y la información más técnica en Scientific Background. Por cierto, Frances H. Arnold, @FrancesArnold, es la quinta mujer en obtener el Premio Nobel de Química, tras Marie Skłodowska-Curie (1911), Irène Joliot-Curie (1935), Dorothy Crowfoot Hodgkin (1964) y Ada E. Yonath (2009).
La idea detrás de este Premio Nobel de Química es que para sintetizar ciertas sustancias químicas orgánicas podemos copiar cómo lo hace la Naturaleza tras miles de años de evolución darwiniana. Frances Arnold obtuvo el título de ingeniería mecánica y aeronáutica en 1979, pero decidió orientar su investigación a la síntesis química bioinspirada de sustancias orgánicas, en concreto, enzimas. Las bacterias se pueden usar como fábricas de enzimas (polipéptidos formados por la repetición en cierto orden de los 20 aminoácidos). Pero para ciertas aplicaciones biotecnológicas nos gustaría optimizar las enzimas que existen en la Naturaleza para mejorar su funcionamiento. Para ello podemos usar un proceso iterativo de diseño racional basado en mutagénesis: se introducen mutaciones en el ADN de los genes que codifican las enzimas que queremos mejorar; se fabrican estas enzimas usando bacterias y se realiza un proceso de selección artificial de las mejores para nuestra aplicación; luego se repite el proceso introduciendo nuevas mutaciones en dichas enzimas. Esta evolución dirigida (también llamada evolución in vitro o diseño “irracional”) permite optimizar el diseño de las enzimas para su uso biotecnológico.
Los primeros trabajos de Arnold se centraron en la síntesis de la subtilisina (serina endopeptidasa), una proteasa (enzima que digiere otras proteínas). Se obtenía a partir de la bacteria Bacillus subtilis, siendo muy usada en productos comerciales, como detergentes de uso doméstico, cosméticos y procesado de alimentos, y en la síntesis de otros compuestos orgánicos. En un artículo publicado en PNAS, Arnold usó la evolución dirigida para modificar una subtilisina incapaz de romper la caseína (proteína de la leche) para obtener una subtilisina modificada (en 10 aminoácidos) que era 256 veces mejor proteasa contra la caseína (K. Chen, F. H. Arnold, “Tuning the activity of an enzyme for unusual environments: sequential random mutagenesis of subtilisin E for catalysis in dimethylformamide,” PNAS 90: 5618-5622 (1993), doi: https://doi.org/10.1073/pnas.90.12.5618). Su éxito fue emulado y mejorado por otros investigadores que convirtieron esta técnica de síntesis y mejora de proteínas como una herramienta imprescindible en biotecnología. Los trabajos de Arnold se dirigieron a la síntesis de biocombustibles (de gran importancia en la producción de energía renovable), y en otros laboratorios hacia la producción de fármacos (medicamentos). Por lo que su trabajo ha contribuido a un mundo más verde.

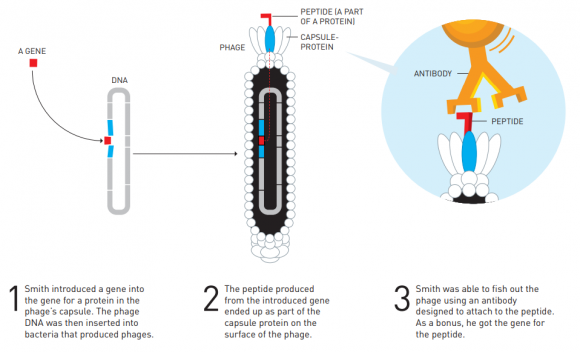
Gregory (Greg) Winter fue de los primeros investigadores que usó la técnica de la presentación de fagos para la fabricación de anticuerpos (moléculas en forma de Y que pueden bloquear muchos procesos bioquímicos asociados a enfermedades). Winter transformó la técnica de la presentación de fagos de Smith en el método más usado para la síntesis de anticuerpos (de hecho, tiene múltiples patentes a su nombre). Ya en 1994 usó este método para fabricar anticuerpos monoclonales que se unen a las células de los tumores cancerígenos (como adalimumab). Estas sustancias se usan en la inmunoterapia oncológica que ha recibido el Premio Nobel de Medicina 2018. Desde 2002 han sido muchos fármacos los que se han fabricado con la técnica de la presentación de fagos para muchas enfermedades. De ahí que las contribuciones de los galardonados con este Nobel de Química son muy relevantes para nuestra sociedad.
Winter, doctor por la Universidad británica de Cambridge, empleó el “phage display” para producir nuevos medicamentos, algo que en la actualidad ha llevado a la producción de anticuerpos que pueden neutralizar toxinas, contraatacar enfermedades del sistema inmunológico y curar incluso el cáncer con metástasis.
Konserthus de Estocolmo y en el Ayuntamiento de Oslo, donde se otorga y entrega el de la Paz.
Fuente: Francis Naukas