El equipo de SLAC-Stanford extrajo hidrógeno directamente de las aguas oceánicas. Su trabajo podría ayudar a los esfuerzos para generar combustible bajo en carbono para redes eléctricas, automóviles, barcos y otras infraestructuras.

David Krause
Por David Krause
La mezcla de hidrógeno, oxígeno, sodio y otros elementos del agua de mar la hace vital para la vida en la Tierra. Pero esa misma química compleja ha dificultado la extracción de gas hidrógeno para usos de energía limpia.
Ahora, investigadores del Laboratorio Nacional de Aceleradores SLAC del Departamento de Energía y la Universidad de Stanford con colaboradores de la Universidad de Oregón y la Universidad Metropolitana de Manchester han encontrado una manera de extraer hidrógeno del océano canalizando agua de mar a través de un sistema de doble membrana y electricidad. Su diseño innovador resultó exitoso en la generación de gas hidrógeno sin producir grandes cantidades de subproductos dañinos. Los resultados de su estudio, publicados hoy en Joule, podrían ayudar a avanzar en los esfuerzos para producir combustibles bajos en carbono.
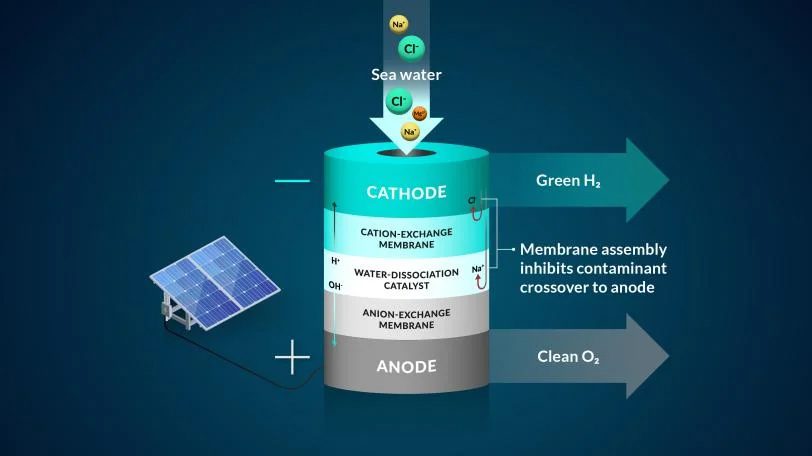
“Muchos sistemas de agua a hidrógeno hoy en día intentan usar una membrana monocapa o de una sola capa. Nuestro estudio reunió dos capas”, dijo Adam Nielander, científico asociado del Centro SUNCAT para Ciencia de Interfaz y Catálisis, un instituto conjunto SLAC-Stanford. “Estas arquitecturas de membrana nos permitieron controlar la forma en que se movían los iones en el agua de mar en nuestro experimento”.
El gas hidrógeno es un combustible bajo en carbono que actualmente se usa de muchas maneras, como para hacer funcionar vehículos eléctricos de celda de combustible y como una opción de almacenamiento de energía de larga duración, que es adecuada para almacenar energía durante semanas, meses o más, para redes eléctricas. .
Muchos intentos de hacer que el gas de hidrógeno comienzan con agua dulce o desalinizada, pero esos métodos pueden ser costosos y consumir mucha energía. Es más fácil trabajar con agua tratada porque tiene menos elementos (elementos químicos o moléculas) flotando. Sin embargo, purificar el agua es costoso, requiere energía y agrega complejidad a los dispositivos, dijeron los investigadores. Otra opción, el agua dulce natural, también contiene una serie de impurezas que son problemáticas para la tecnología moderna, además de ser un recurso más limitado en el planeta, dijeron.
Para trabajar con agua de mar, el equipo implementó un sistema de membrana bipolar o de dos capas y lo probó usando electrólisis, un método que usa electricidad para impulsar iones, o elementos cargados, para ejecutar una reacción deseada. Comenzaron su diseño controlando el elemento más dañino para el sistema de agua de mar, el cloruro, dijo Joseph Perryman, investigador postdoctoral de SLAC y Stanford.

“Hay muchas especies reactivas en el agua de mar que pueden interferir con la reacción de agua a hidrógeno, y el cloruro de sodio que hace que el agua de mar sea salada es uno de los principales culpables”, dijo Perryman. “En particular, el cloruro que llega al ánodo y se oxida reducirá la vida útil de un sistema de electrólisis y, de hecho, puede volverse inseguro debido a la naturaleza tóxica de los productos de oxidación que incluyen cloro molecular y lejía”.
La membrana bipolar en el experimento permite el acceso a las condiciones necesarias para producir gas hidrógeno y evita que el cloruro llegue al centro de reacción.
“Básicamente estamos duplicando las formas de detener esta reacción de cloruro”, dijo Perryman.
Un hogar para el hidrógeno
Un sistema de membrana ideal realiza tres funciones principales: separa los gases de hidrógeno y oxígeno del agua de mar; ayuda a mover solo los iones de hidrógeno e hidróxido útiles mientras restringe otros iones de agua de mar; y ayuda a prevenir reacciones no deseadas. Capturar estas tres funciones juntas es difícil, y la investigación del equipo está dirigida a explorar sistemas que puedan combinar eficientemente estas tres necesidades.
Específicamente en su experimento, los protones, que eran los iones de hidrógeno positivos, pasaron a través de una de las capas de la membrana a un lugar donde podían recolectarse y convertirse en gas hidrógeno al interactuar con un electrodo o cátodo cargado negativamente. La segunda membrana del sistema solo permitía el paso de iones negativos, como el cloruro.
Como barrera adicional, una capa de la membrana contenía grupos cargados negativamente que estaban fijados a la membrana, lo que dificultaba que otros iones cargados negativamente, como el cloruro, se movieran a lugares donde no deberían estar, dijo Daniela Marin, graduada de Stanford. estudiante de ingeniería química y coautor. La membrana con carga negativa demostró ser muy eficaz para bloquear casi todos los iones de cloruro en los experimentos del equipo, y su sistema funcionó sin generar subproductos tóxicos como lejía y cloro.
Junto con el diseño de un sistema de membrana de agua de mar a hidrógeno, el estudio también proporcionó una mejor comprensión general de cómo los iones de agua de mar se mueven a través de las membranas, dijeron los investigadores. Este conocimiento podría ayudar a los científicos a diseñar membranas más fuertes para otras aplicaciones, como la producción de oxígeno gaseoso.
“También hay cierto interés en usar la electrólisis para producir oxígeno”, dijo Marin. “Comprender el flujo de iones y la conversión en nuestro sistema de membrana bipolar también es fundamental para este esfuerzo. Además de producir hidrógeno en nuestro experimento, también mostramos cómo usar la membrana bipolar para generar oxígeno gaseoso”.

A continuación, el equipo planea mejorar sus electrodos y membranas construyéndolos con materiales más abundantes y fáciles de extraer. Esta mejora de diseño podría hacer que el sistema de electrólisis sea más fácil de escalar al tamaño necesario para generar hidrógeno para actividades intensivas en energía, como el sector del transporte, dijo el equipo.
Los investigadores también esperan llevar sus celdas de electrólisis a la fuente de luz de radiación de sincrotrón de Stanford (SSRL) de SLAC, donde pueden estudiar la estructura atómica de los catalizadores y las membranas utilizando los rayos X intensos de la instalación.
“El futuro es brillante para las tecnologías de hidrógeno verde”, dijo Thomas Jaramillo, profesor de SLAC y Stanford y director de SUNCAT. “Los conocimientos fundamentales que estamos obteniendo son clave para informar futuras innovaciones para mejorar el rendimiento, la durabilidad y la escalabilidad de esta tecnología”.
Este proyecto cuenta con el apoyo de la Oficina de Investigación Naval de los Estados Unidos; el Acelerador de la Escuela de Sostenibilidad de Stanford Doerr; la Oficina de Ciencias Energéticas Básicas, Ciencias Químicas, Geociencias y Biociencias del DOE a través del Centro SUNCAT para Ciencias de Interfaz y Catálisis, un instituto conjunto SLAC-Stanford; y la Oficina de Tecnologías de Celdas de Combustible de Energía Renovable y Eficiencia Energética del DOE.
Convertir el agua de mar en combustible de hidrógeno
SLAC es un vibrante laboratorio multiprograma que explora cómo funciona el universo en las escalas más grandes, más pequeñas y más rápidas e inventa herramientas poderosas utilizadas por científicos de todo el mundo. Con investigaciones que abarcan la física de partículas, la astrofísica y la cosmología, los materiales, la química, las ciencias biológicas y energéticas y la computación científica, ayudamos a resolver problemas del mundo real y promover los intereses de la nación.
SLAC es operado por la Universidad de Stanford para la Oficina de Ciencias del Departamento de Energía de EE. UU . La Oficina de Ciencias es el mayor patrocinador individual de la investigación básica en ciencias físicas en los Estados Unidos y está trabajando para abordar algunos de los desafíos más apremiantes de nuestro tiempo. Convertir el agua de mar en combustible de hidrógeno