Proteínas inmunes guían el diseño de fármacos
Imágenes nítidas del par de proteínas inmunes prometen guiar el diseño de fármacos
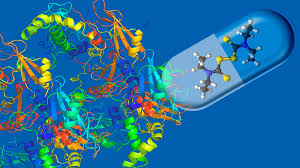
Investigadores del Instituto Blavatnik de la Home | Harvard Medical School han reunido las estructuras casi atómicas de un par de proteínas cruciales para la función de las células B: células inmunes que producen anticuerpos y recuerdan cómo luchar contra invasores específicos mucho después de una infección.

El trabajo proporciona detalles invaluables que pueden orientar el diseño de nuevas terapias que inhabiliten las células B disfuncionales o aumenten la actividad de las células B sanas para tratar enfermedades como el linfoma, las deficiencias inmunitarias y los trastornos autoinmunitarios.
“Hay tanto que se desconoce acerca de cómo se ven estos tipos de proteínas, qué hacen y cómo se unen sus formas y funciones”, dijo Katherine Susa , estudiante de posgrado en biología química en los laboratorios de los biólogos estructurales del HMS Stephen Blacklow y Andrew Kruse y primer autor del estudio, publicado el 15 de enero en Science .

proteínas inmunes guían el diseño de fármacos
“Nuestro descubrimiento es emocionante tanto desde la perspectiva de la biología estructural como porque podría tener importancia para combatir las enfermedades”.
Enigma del co-receptor
Cuando una célula B detecta un antígeno, una proteína que indica un enemigo, ya sea un virus o una señal falsamente interpretada de los propios tejidos sanos de una persona, una proteína en la superficie de la célula B conocida como receptor de la célula B se adhiere, lo que dificulta la capacidad del invasor. para causar daño.
La unión pone en marcha otro par de proteínas, CD81 y CD19. Se unen para formar el correceptor de células B, que ayuda a activar las células B y hace que sus defensas sean unas 1.000 veces más eficaces .
Pero nadie sabía cómo era el correceptor. Los grupos de Blacklow y Kruse habían descubierto previamente la estructura de CD81 , y otro grupo había descifrado CD19, pero era posible que las dos proteínas se transformaran cuando se unían.
Descubrir las complejidades estructurales del correceptor proporcionaría una imagen nítida para ayudar a los investigadores a diseñar medicamentos que se unan con precisión a partes de CD81 o CD19 y se unan solo a ellas, reduciendo los efectos no deseados en el cuerpo. Aunque los investigadores han desarrollado un puñado de medicamentos aprobados por la FDA hasta ahora que actúan sobre el correceptor, han estado apuntando a un objetivo borroso.
Susa estaba decidida a encontrar la respuesta, pero hacerlo no sería fácil.
El correceptor era demasiado grande para que ella usara la resonancia magnética nuclear, una técnica común de determinación de estructuras. Sin embargo, era demasiado pequeño para obtener imágenes con otro enfoque, la microscopía crioelectrónica.

proteínas inmunes guían el diseño de fármacos
El hogar de las proteínas en la membrana celular aceitosa hizo que la cristalografía de rayos X fuera una propuesta complicada. Susa luchó, incluso con una técnica revolucionaria que Kruse había desarrollado para preparar proteínas de membrana para cristalografía.
Así que Susa se asoció con Shaun Rawson , un especialista en computación del Centro de Microscopía Crioelectrónica de Harvard para Biología Estructural , que estaba listo para unirse al desafío.
“El correceptor no es el objeto más pequeño del que se haya obtenido una imagen con crio-EM, pero ciertamente es el más pequeño con el que he trabajado”, dijo Rawson. “Ofreció un buen desafío en varios niveles”.
El microscopio, junto con una bioquímica innovadora , descifró el misterio.
“Cryo-EM permitió este trabajo de una manera que otras técnicas estructurales no lo hicieron”, dijo Rawson.

Caso de ‘abrir y cerrar’
Susa y sus colegas estaban emocionados de descubrir que CD81 “se abre y se reorganiza completamente” cuando se une a CD19, dijo.
El equipo descubrió que la porción de CD81 que se encuentra en la superficie de las células B se despliega para unirse a CD19, mientras que la porción incrustada en la membrana celular se cierra para negar la entrada a las moléculas de colesterol.
Estos cambios nunca se habían visto antes en las tetraspaninas, la familia de proteínas a la que pertenece CD81.
“La gente ha pensado que los tetraspaninos son estáticos. Esto demuestra que son muy dinámicos y tienen múltiples estados en función de si el colesterol está unido ”, dijo Susa. “Eso nos da una idea de lo que están haciendo en el cuerpo”.

El trabajo proporciona orientación para los científicos que intentan aumentar o reducir la actividad de las células B como una forma de tratar enfermedades.
Por ejemplo, se sabe que una mutación genética en el correceptor provoca una inmunodeficiencia. La activación de esas células B de bajo rendimiento podría aumentar la fuerza inmunológica de los pacientes.
Por el contrario, ciertos cánceres obligan al correceptor a permanecer encendido, empujando a las células B a un estado de hiperactividad y proliferación. Las terapias modernas de células T con CAR destruyen las células B para combatir el cáncer. El trabajo de Susa y sus colegas podría permitir a los investigadores desarrollar medicamentos que maten solo las células B cancerosas y no afecten a las sanas.
“La gimnasia molecular de CD81 es asombrosa y realmente da vida a parte de la última materia oscura que queda del proteoma humano, con importantes implicaciones de traslación”, dijo Blacklow , profesor de Química Biológica y Farmacología Molecular de Gustavus Adolphus Pfeiffer en HMS y co- autor principal del artículo con Kruse , profesor de química biológica y farmacología molecular en HMS.
El trabajo podría tener una aplicabilidad clínica aún más amplia si, como sospecha Blacklow, otras tetraspaninas experimentan cambios estructurales similares en la activación. Su grupo ya ha comenzado a investigar.
Este trabajo fue financiado por los Institutos Nacionales de Salud ( subvenciones R35CA220340, F31HL147459 y DP5OD021345).
Blacklow recibe financiación para un proyecto no relacionado de Novartis; está en el consejo científico asesor de Erasca, Inc .; es asesor de MPM Capital; y es consultor de IFM, Scorpion Therapeutics y Ayala Pharmaceuticals para proyectos no relacionados. Kruse es cofundador y asesor en proyectos no relacionados para el Institute for Protein Innovation, un instituto de investigación sin fines de lucro, y fundador de Tectonic Therapeutic, una empresa de biotecnología con fines de lucro.