Los investigadores desarrollan una nueva técnica de remedio para la psoriasis
Ponerse debajo de la piel de la psoriasis
22 de julio de 2020
La tecnología basada en líquido iónico proporciona ARN terapéutico para bloquear localmente los genes asociados a la psoriasis en ratones
Por Lindsay Brownell

Las simulaciones de dinámica molecular mostraron que las diferentes especies de iones dentro del líquido iónico CAGE + CAPA (rojo, azul, púrpura) interactuaron fuertemente con los átomos de siRNA (blanco), ayudándolo a retener su estructura. Crédito Instituto Wyss de la Universidad de Harvard.
(BOSTON) – La psoriasis, una afección crónica de la piel que causa picazón, manchas rojas y escamosas, afecta a más de 8 millones de estadounidenses y 125 millones de personas en todo el mundo. Los medicamentos a base de moléculas pequeñas como los esteroides pueden penetrar la piel para tratar la afección, pero pueden causar irritación y adelgazamiento de la piel y su eficacia puede disminuir con el tiempo. Se han desarrollado anticuerpos que se dirigen a moléculas específicas relacionadas con la inflamación asociadas con la psoriasis, pero debido a que no se pueden administrar a través de la piel, se inyectan con agujas y jeringas, lo que limita su aceptación y puede tener efectos secundarios sistémicos negativos.
Un equipo de investigadores del Instituto Wyss de Ingeniería Biológica de Harvard y la Escuela de Ingeniería y Ciencias Aplicadas (SEAS) John A. Paulson han eludido estas limitaciones al usar una combinación de líquido iónico (IL) para administrar con éxito un pequeño ARN interferente (ARNip) tratamiento basado directamente en la piel en un modelo de psoriasis en ratones, reduciendo significativamente los niveles de citoquinas inflamatorias y los síntomas de la psoriasis sin efectos secundarios sistémicos. La investigación se publica hoy en Science Advances .

Abhirup Mandal, Ph.D._1
“En comparación con otras tecnologías que han demostrado la entrega de ácidos nucleicos a la piel, nuestra plataforma IL ofrece oportunidades únicas en términos de capacidad de ajuste, un excelente perfil de seguridad y una ampliación económica”, dijo el primer autor Abhirup Mandal, Ph.D., un ex becario postdoctoral en el Instituto Wyss y SEAS que ahora es un investigador científico senior en CAGE Bio. “Creemos que la administración tópica efectiva de macromoléculas revolucionará las opciones de tratamiento para los trastornos dermatológicos debilitantes como la psoriasis”.
Ejecutar simulaciones para predecir el éxito real
Los siRNA sintéticos son moléculas de ARN bicatenarias no codificantes que se usan de manera rutinaria en la investigación biológica para “silenciar” un gen objetivo mediante la destrucción de las transcripciones de ARN del gen. Esta capacidad también los convierte en candidatos muy atractivos para tratar enfermedades y trastornos sin modificar el ADN en las células de un paciente. Sin embargo, su uso en medicina se ha visto obstaculizado porque los ARN son moléculas grandes e hidrofílicas y, por lo tanto, tienen dificultades para cruzar las membranas hidrofóbicas de las células.
El equipo del Instituto Wyss y SEAS abordó ese desafío utilizando una clase de material recientemente descubierto llamado líquidos iónicos (IL), que son esencialmente sales que son líquidas a temperatura ambiente. Según investigaciones anteriores que investigaron las interacciones de las IL con los lípidos, los investigadores tenían el presentimiento de que las IL podrían estabilizar los siRNA y mejorar su penetración a través de las membranas celulares basadas en lípidos, permitiendo el silenciamiento genético localizado.
Nueva técnica de remedio para la psoriasis Nueva técnica de remedio para la psoriasis Nueva técnica de remedio para la psoriasis Nueva técnica de remedio para la psoriasis
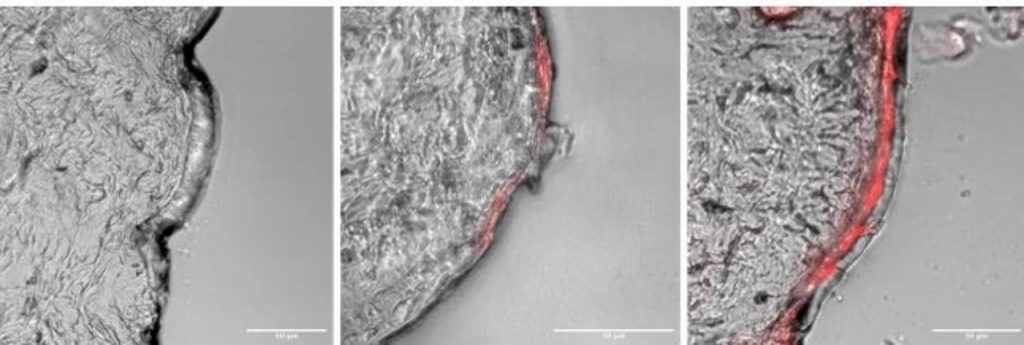
IL-siRNA Figure 4C

Charles Reilly.,
El equipo primero creó una biblioteca de diferentes IL, luego probó combinaciones de ellas para ver cuáles tenían las propiedades físicas y químicas que estaban buscando. Se decidieron por una mezcla de dos: CAGE (colina y ácido geranico) y CAPA (colina y ácido fenilpropanoico), que ayudaron a las moléculas de ARNip asociadas a conservar su integridad estructural y aumentaron la penetración de ARNip en la piel de cerdo in vitro . Cuando aplicaron la mezcla CAGE + CAPA como un líquido tópico espeso sobre la piel de los ratones vivos, no observaron inflamación ni irritación, lo que indica que no era tóxico.
Debido a que los IL son un material bastante nuevo, predecir sus interacciones con las cargas que deben entregar es un desafío. Los investigadores colaboraron con el coautor Charles Reilly., Ph.D., científico sénior en la plataforma Bioinspired Therapeutics & Diagnostics en el Instituto Wyss, para realizar simulaciones de dinámica molecular para modelar y comprender cómo la solución CAGE + CAPA interactuaría con el siRNA y las membranas celulares a nivel molecular. Las observaciones de esas simulaciones predijeron que este complejo de IL-siRNA tenía una estabilidad superior debido a las fuertes interacciones químicas de sus iones componentes con los pares de bases de ARN. El modelo también sugirió que condujo a una mayor penetración de las membranas celulares porque los iones en la IL fueron capaces de empaquetarse estrechamente, formando agregados que aumentaron la capacidad del complejo para interrumpir la membrana y permitir la entrada del siRNA.
Derribando barreras
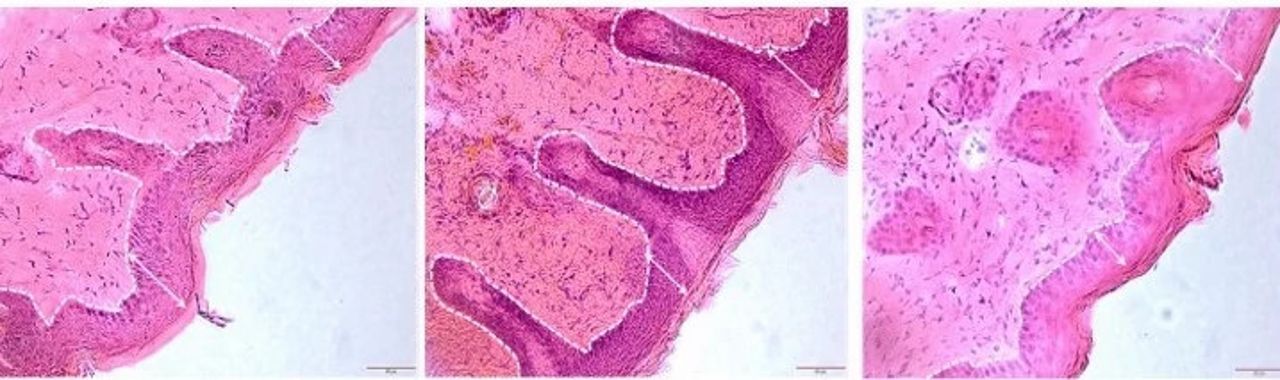
IL-siRNA Figure 5C
Armado con un vehículo de entrega efectivo, el equipo lo combinó con un ARNip específico diseñado para silenciar un gen llaPmado NFKBIZ, que ha estado implicado en la regulación positiva de una serie de moléculas inflamatorias que están involucradas en la psoriasis. Aplicaron la mezcla CAGE + CAPA junto con el siRNA a la piel de ratones con una condición similar a la psoriasis durante cuatro días, luego compararon esos ratones con otros que habían recibido CAGE + CAPA con un siRNA de control, CAGE + CAPA solo, o no tratamiento.
Los ratones que recibieron el tratamiento con ARNip NFKBIZ habían reducido el engrosamiento epidérmico, la decoloración de la piel y el crecimiento excesivo de queratina en comparación con los otros grupos experimentales, así como menos enrojecimiento y descamación. También mostraron una reducción significativa en la expresión de NFKBIZ y otros productos génicos relacionados con la psoriasis en sus células de la piel, lo que demuestra por primera vez que los complejos de IL-siRNA pueden inducir un efecto terapéutico tanto a nivel molecular como macroscópico al silenciar un gen diana en vivo después de la administración tópica.

Samir Mitragotri, Ph.D.
“Las cremas tópicas se han utilizado para tratar afecciones de la piel durante cientos de años, pero la piel es una barrera muy efectiva contra la mayoría de las sustancias, lo que limita su efectividad. Ser capaz de salvar esa barrera para administrar terapias de ácido nucleico directamente a las células de la piel es un gran logro en la búsqueda de terapias efectivas y dirigidas “, dijo el autor correspondiente Samir Mitragotri , Ph.D., quien es miembro de la Facultad del Instituto Wyss. y el Profesor Hiller de Bioingeniería y el Profesor Hansjörg Wyss de Ingeniería Biológicamente Inspirada en SEAS.
Esta plataforma de entrega basada en IL se puede ampliar y ajustar fácilmente para interactuar con una variedad de moléculas terapéuticas, que incluyen ADN y anticuerpos. También podría potenciar la administración transdérmica de medicamentos para el tratamiento de otras afecciones dermatológicas de la piel, incluido el eccema, y mejorar la eficacia a largo plazo de las terapias al dirigirse a genes que median en múltiples vías de enfermedad.
DONALD INGBER
Esta solución creativa para este problema de administración de medicamentos es muy prometedora para permitir una nueva clase de tratamientos efectivos que se han retrasado mucho.
En base a los resultados alentadores de este estudio, el laboratorio de Mitragotri está iniciando nuevas colaboraciones con investigadores de varias instituciones que se centran en comprender los mecanismos locales y sistémicos asociados con enfermedades autoinmunes e inflamatorias en la piel.
“Muchas de las innovaciones que los biólogos han estado utilizando en la investigación durante años tienen un potencial clínico significativo, pero la mayoría no lo han logrado debido a factores limitantes fundamentales como, en este caso, la barrera que representa la piel. Esta solución creativa para este problema de administración de medicamentos es muy prometedora para permitir una nueva clase de tratamientos efectivos que están muy atrasados ”, dijo el Director Fundador del Instituto Wyss y coautor del documento Donald Ingber , MD, Ph.D., quien es también el profesor Judah Folkman de Biología Vascular en la Facultad de Medicina de Harvard y el Hospital de Niños de Boston, y el Profesor de Bioingeniería en SEAS.
Otros autores del artículo incluyen a Ninad Kumbhojkar y Anvay Ukidve del Instituto Wyss y SEAS, y Vimisha Dharamdasani, anteriormente del Instituto Wyss y SEAS y actualmente en la Universidad de Cambridge.
Esta investigación fue apoyada por la Fundación Leo y el Instituto Wyss de Ingeniería Biológicamente Inspirada en la Universidad de Harvard.



